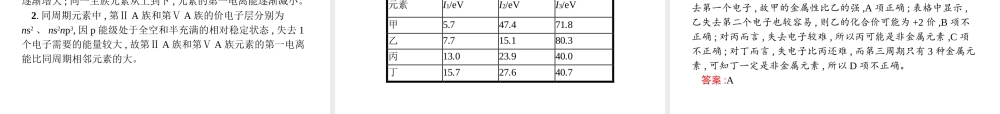
第2课时元素周期律目标导航预习导引1.掌握原子半径在同周期、同主族的变化规律。2.掌握微粒半径大小的比较方法。3.掌握第一电离能的定义、变化规律及其应用。4.掌握电负性的定义、变化规律及其应用1.掌握原子半径在同周期、同主族的变化规律。2.掌握微粒半径大小的比较的方法。3.掌握第一电离能、电负性的定义,变化规律及其应用目标导航预习导引一二三四一、原子半径1.影响因素:原子半径的大小取决于电子的能层数、核电荷数两个因素。2.规律:随着电子的能层数增多,电子之间的负电排斥使原子半径逐渐增大;核电荷数越大,原子核对核外电子的引力越大,将使原子半径缩小。电子能层数多的元素原子半径是否一定大于电子能层数少的元素原子半径?答案:不一定,原子半径的大小由核电荷数与电子的能层数两个因素综合决定,如碱金属元素的原子半径比它下一周期卤族元素的原子半径大。目标导航预习导引一二三四二、电离能1.定义:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。2.应用:第一电离能可以衡量元素的原子失去一个电子的难易程度。第一电离能数值越小,原子越容易失去一个电子。3.元素第一电离能符号:I1。4.元素第一电离能的变化规律:(1)对同一周期的元素而言,氢和碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大;从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子。(2)同主族元素,自上而下第一电离能逐渐减小,表示自上而下元素原子越来越易失去电子。目标导航预习导引一二三四有人说:“金属越活泼,其第一电离能越小”,你同意这种说法吗?谈一谈你的观点。答案:不同意。金属活动性按K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)Cu、Hg、Ag、Pt、Au的顺序减弱,该顺序中自左向右,在水溶液或酸中金属元素原子失去电子越来越困难。而第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。金属活动性的强弱与第一电离能大小的判断标准不同,故二者没有必然关系。目标导航预习导引一二三四三、电负性1.键合电子和电负性的含义(1)键合电子。元素相互化合时,原子中用于形成化学键的电子称为键合电子。(2)电负性。电负性是用来描述不同元素的原子对键合电子吸引力的大小。电负性越大的原子,对键合电子的吸引力越大。2.衡量标准以氟的电负性为4.0作为相对标准,得出各元素的电负性。3.递变规律(1)一般来说,同周期自左到右元素的电负性逐渐变大。(2)一...