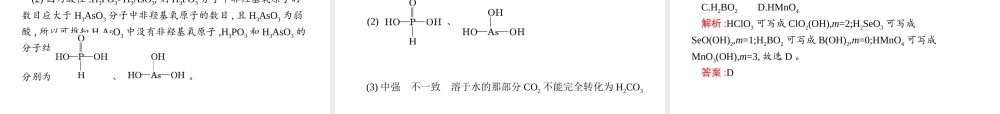
第2课时溶解性、手性、无机含氧酸分子的酸性目标导航预习导引1.了解常见物质的溶解性,能用“相似相溶”原理来解释有关物质的溶解性。2.了解手性原子、手性分子的概念,能准确判断有机物中是否含有手性碳原子。3.掌握常见酸的酸性强弱,能比较不同含氧酸的酸性强弱1.从结构的角度认识“相似相溶”规律。2.学会判断手性分子。3.能判断与解释无机含氧酸的酸性强弱目标导航预习导引一二三一、溶解性1.“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。2.应用:水是极性溶剂,根据“相似相溶”的规律,极性溶质比非极性溶质在水中的溶解度大。如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较小。此外,“相似相溶”还适用于分子结构的相似性。例如,乙醇能与水互溶,而戊醇在水中的溶解度明显减小。目标导航预习导引一二三为什么NH3极易溶于水,而CH4难溶于水?答案:NH3是极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律,NH3易溶于水,而CH4不易溶于水。并且NH3与H2O分子之间还可以形成氢键,使得NH3更易溶于水。目标导航预习导引一二三二、手性具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。有手性异构体的分子叫做手性分子。目标导航预习导引一二三三、无机含氧酸分子的酸性我们常把H2SO4、HNO3等无机含氧酸看成是由氢离子和酸根离子组成的。实际上在含氧酸分子结构中,氢离子却是和酸根上的一个氧相连接的,故两种酸的结构可表示为通过比较常见同种元素形成的含氧酸的酸性强弱后不难看出,对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强。、。目标导航预习导引一二三强酸溶液的酸性一定强于弱酸溶液的酸性吗?答案:不一定。溶液的酸性取决于溶液中氢离子浓度的大小,氢离子浓度越大,溶液的酸性越强。一二三知识精要典题例解迁移应用一、影响物质溶解性的因素1.内因:(1)分子结构——“相似相溶”规律。(2)氢键——如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键作用力越大,溶解度越大。(3)发生反应——溶质与水发生反应时可增大其溶解度,如SO2与H2O反应生成H2SO3,SO3与H2O反应生成H2SO4,NH3与H2O反应生成NH3·H2O等。2.外因:(1)温度——一定压强下,温度越高,气体的溶...