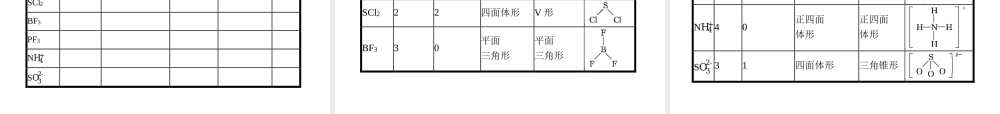
第二节分子的立体构型第1课时形形色色的分子与价层电子对互斥理论目标导航预习导引1.掌握常见分子的立体构型。2.了解价层电子对互斥理论,掌握孤电子对的计算公式。3.能根据价层电子对数判断VSEPR模型的空间形状,并能判断分子的立体构型利用价层电子对互斥理论预测分子的立体构型目标导航预习导引一二一、形形色色的分子1.三原子分子三原子分子的立体构型有直线形(如CO2)和V形(如H2O)两种。2.四原子分子四原子分子主要有平面三角形、三角锥形两种立体结构。例如甲醛分子呈平面三角形;氨分子呈三角锥形,键角107°。3.五原子分子五原子分子最常见的立体构型为正四面体形,如CH4,键角为109°28'。目标导航预习导引一二依据元素周期律的知识,请你大胆推测分别与CO2、H2O、NH3、CH4分子结构相似的分子有哪些?(各举一例即可)答案:CO2与CS2,H2O与H2S,NH3与PH3,CH4与SiH4的结构相似。目标导航预习导引一二二、价层电子对互斥理论1.概述价层电子对互斥理论认为,分子的立体构型是“价层电子对”相互排斥的结果。价层电子对是指分子中的中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。目标导航预习导引一二2.价层电子对数的确定(1)σ键电子对数可由分子式确定。中心原子的σ键电子对数等于其配位原子数。(2)中心原子上的孤电子对数的确定方法如下:中心原子上的孤电子对数=。a为中心原子的价电子数,对于主族元素来说,价电子数等于原子的最外层电子数。x为与中心原子结合的原子数。b为与中心原子结合的原子最多能接受的电子数,氢为1,其他原子等于“8-该原子的价电子数”。12(a-xb)目标导航预习导引一二3.VSEPR模型的应用——预测分子或离子的立体构型(1)中心原子不含孤电子对的分子。中心原子不含孤电子对的分子,VSEPR模型与分子的立体构型一致,例如:目标导航预习导引一二分子或离子σ键电子对数孤电子对数VSEPR模型及名称分子或离子的立体构型及名称CO220直线形直线形CO32-30平面三角形平面三角形CH440正四面体形正四面体形目标导航预习导引一二(2)中心原子含孤电子对的分子。中心原子若有孤电子对,孤电子对也要占据中心原子的空间,并与成键电子对互相排斥。则VSEPR模型与分子的立体构型不一致。推测分子的立体模型必须略去VSEPR模型中的孤电子对,例如:目标导航预习导引一二分子价层电子对数孤电子对数VSEPR模型及名称分子的立体构型及名称NH341四面体形三角锥形H2O42四面体形V形SO231平面三角形V形目标导航预习导引一二四原子分子都为平面三角形或三...