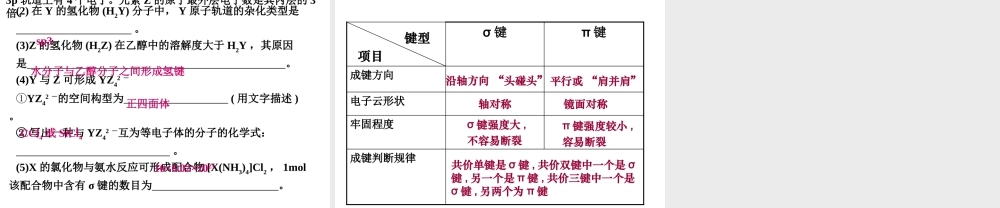
第二章分子结构与性质(复习课)知识体系•共价键(及配位键)形成、特点、键参数•分子的立体构型常见空间构型及理论解释•分子的性质分子与分子之间的关系(等电子原理、手性异构)、分子本身的性质(极性与非极性、含氧酸的酸性)、分子与分子之间的作用(范德华力、氢键及对分子性质的影响)一、共价键1、分类(1)按共用电子对数分单键双键三键(2)按极性分极性键非极性键(3)按成键方式分2、键参数σ键π键键能键长键角衡量化学键的稳定性描述分子的立体构型的重要因素一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。(共价键极性强弱的比较:电负性差值越大,极性越强)3、特殊的共价键—配位键•成键特点:一方提供孤对电子,一方提供空轨道•配离子:中心离子、配体、配位原子、配位数讨论1:(13四川)短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是()A.W、Y、Z的电负性大小顺序一定是Z>Y>WB.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>ZC.Y、Z形成的分子空间构型可能是正四面体D.WY2分子中σ键与π键的数目之比是2:1C讨论2:(13山东)(3)BCl3和NCl3中心原子的杂化方式分别为________和_________。第一电离能介于B、N之间的第二周期元素有________种。(4)若BCl3与XYm通过B原子与X原子间的配位健结合形成配合物,则该配合物中提供孤对电子的原子是________。sp2sp3X3讨论:(13全国)硅是重要的半导体材料。回答下列问题:(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列事实:①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是。②SiH4的稳定性小于CH4,更易生成氧化物,原因是。(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为。Si与O的原子数之比为化学式为________________硅烷中的Si-Si键和Si-H键的键能小于烷烃分子中C-C键和C-H键的键能,稳定性差,易断裂,导致长链硅烷难以形成,所以硅烷在种类和数量上都远不如烷烃多。由于键能越大,物质越稳定,C-H键的键能大于C-O键的键能,故C-H键比C-O键稳定;而Si-H键的键能却远小于Si-O键的键能,所以Si-H键不稳定,而倾向于形成稳定性更强的Si-O键,即更易生成氧化物...