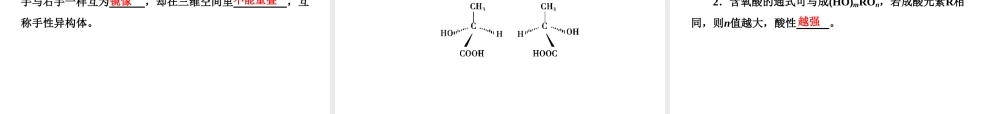
教师用书独具演示第2课时溶解性手性无机含氧酸分子的酸性●课标要求1.实验:“相似相溶”规则的实际应用。2.了解“手性分子”在生命科学等方面的应用。3.查阅资料:“手性分子”的合成及应用,从分子结构的角度解释无机含氧酸分子的酸性。●课标解读1.了解“相似相溶”规律。2.会判断“手性分子”。3.能用分子结构的知识解释无机含氧酸分子的酸性。●教学地位本课时在选修3中的地位也比较显著,虽然它是了解内容,课程标准上含氧酸酸性强弱判断虽没有提到,相似相溶原理、手性问题在各高考考区的考纲上选修3部分虽没有显示,但高考试题上也偶尔出现。●新课导入建议复习极性键非极性键,极性分子和非极性分子并举出常见的极性分子和非极性分子。通过前面的学习我们知道碘易溶于四氯化碳而不易溶于水,氨和氯化氢易溶于水,这是为什么呢?●教学流程设计演示结束课标解读重点难点1.了解“相似相溶”原理。2.了解“手性分子”在生命科学等方面的应用。3.能用分子结构的知识解释无机含氧酸分子的酸性。1.从结构的角度,认识“相似相溶”规律。(重点)2.学会判断“手性分子”。(难点)3.能判断与解释无机含氧酸酸性强弱。(重难点)1.“相似相溶”规律非极性溶质一般能溶于溶剂,极性溶质一般能溶于溶剂。如蔗糖和氨易溶于水,溶于CCl4,而苯和碘却溶于CCl4,溶于水。非极性极性难易难2.影响溶解性的因素除了温度、压强外,还有许多制约因素影响物质的溶解性。(1)氢键:溶剂和溶质之间的氢键作用力越大,溶解性越。(2)分子结构的相似性:CH3CH2OH中的—OH与水中的—OH相近,因而乙醇能与水;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的—OH跟水中—OH的相似因素被弱化,因而在水中的溶解度。好互溶明显减小(3)溶质与溶剂发生化学反应:如SO2与水反应生成H2SO3,H2SO3可溶于水,因此将增加SO2的。溶解度1.有机溶剂都是非极性溶剂吗?【提示】有机溶剂大多数是非极性溶剂,如CCl4、C6H6等,但也有少数的极性溶剂,如酒精。1.手性异构体具有完全相同的和的一对分子,如同左手与右手一样互为,却在三维空间里,互称手性异构体。组成原子排列镜像不能重叠1.对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性。2.含氧酸的通式可写成(HO)mROn,若成酸元素R相同,则n值越大,酸性。越强越强2.强酸的水溶液酸性一定比弱酸的水溶液酸性强吗?【提示】不一定,如很稀的稀硫酸的酸性没有饱和亚硫酸溶液的酸性强,溶液的酸性强弱除与酸的强弱...