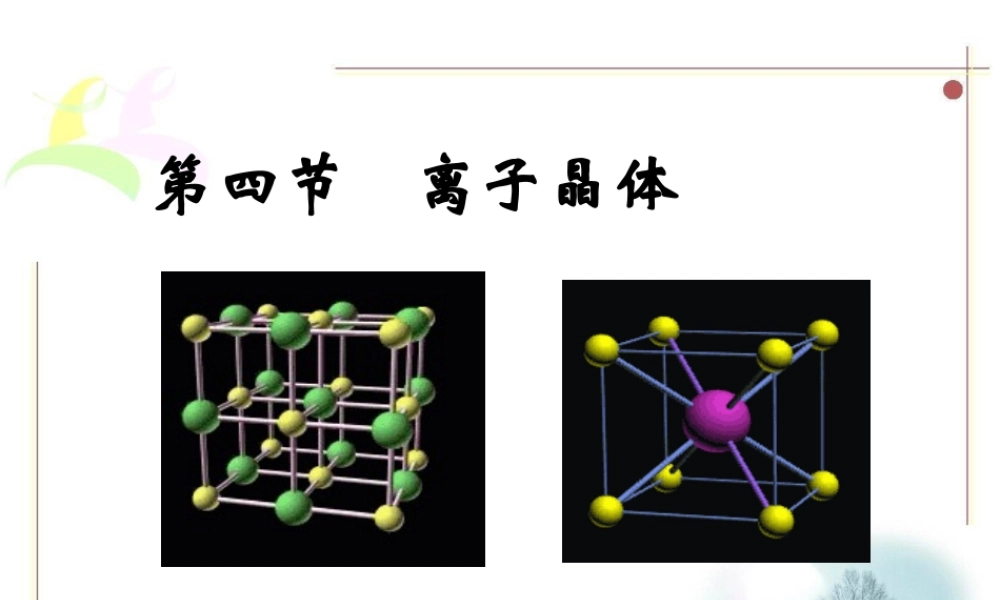
第四节离子晶体高二化学备课组唐爱华1、了解羧酸、酯典型代表物的组成、结构特点、主要性质及重要应用。考点要求:【学案批阅反馈】1、出现的问题:上交份数不全(41份),内容填写不详实,部分学生书写欠规范。2、学案完成较认真的同学:唐健、李文玉、翟慧倩、刘波、滕树龙张强、张倩、王维维、刘霞、王莲英刘宁宁、王璐、宋奎、白如霜、张成梅学.科.网2Na+Cl2==2NaCl+11+17+17+11Na+Cl-NaClCl-Na+1、了解羧酸、酯典型代表物的组成、结构特点、主要性质及重要应用。考点要求:【学习目标】1.知识与技能:了解离子晶体的结构模型及其性质的一般特点。了解离子晶体配位数及其影响因素。2.过程与方法:比较离子晶体与分子晶体、原子晶体、金属晶体在晶体结构上的区别和性质上的差异,从晶体结构的微观角度去解释物质的物理性质3.情感态度与价值观:学会知识的运用,培养学以致用的能力【学习重点】理解离子晶体的结构模型及其性质的一般特点。【学习难点】了解离子晶体配位数及其影响因素。1、了解羧酸、酯典型代表物的组成、结构特点、主要性质及重要应用。考点要求:典型晶体探究乙有对称轴;有与边垂直的对称面——黄色的面;有对称中心……对称性与晶体相同。甲乙甲没有与边垂直的对称面;没有对称中心……对称性不能代表晶体。乙为NaCl的晶胞。晶胞代表整个晶体,无数个晶胞堆积起来,则得到晶体学.科.网钠离子和氯离子的位置:①钠离子和氯离子位于立方体的顶角上,并交错排列。②钠离子:体心和棱中点;氯离子:面心和顶点,或者反之。学.科.网氯化钠型晶胞---Cl----Na+NaCl的晶体结构模型在氯化钠晶体中,假若钠离子与周围最近的氯离子的距离为a,每个钠离子周围最近且等距离的氯离子有6个,那么钠离子有___个,钠离子之间的距离为____。122aaab氯化铯型晶胞---Cs+---Cl-CsCl的晶体结构示意图返回原处决定离子晶体结构的因素•几何因素几何因素–晶体中正负离子的半径比•电荷因素–晶体中正负离子的电荷比•键性因素–离子键的纯粹因素离子晶体原子晶体分子晶体金属晶体存在微粒阴阳离子原子分子金属离子、自由电子微粒间作用离子键共价键范德华力金属键主要性质硬而脆,易溶于极性溶剂,熔化时能够导电,溶沸点高质地硬,不溶于大多数溶剂,导电性差,熔沸点很高硬度小,水溶液能够导电,溶沸点低金属光泽,是电和热的良导体,熔沸点高或低实例食盐晶体金刚石氨、氯化氢镁、铝各种晶体类型的比较1、了解羧酸、酯典型代表物的组成、结构特点、...