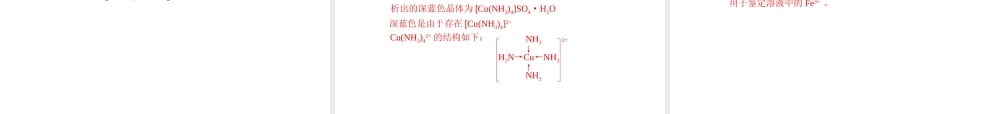
分子的立体构型一、形形色色的分子共价键具有方向性,分子中原子之间存在一定的键角,这就导致了分子具有一定的几何特性,也就是“分子的立体构型”。三原子分子:四原子分子:五原子分子:直线形和V形平面三角形和三角锥形正四面体形化学式结构式分子的立体模型CO2H2OCH2ONH3CH4O=C=OOHHO=CHHHHNHHHCHH船式C6H12椅式C6H12C60P4O6P4O10P4C10H16S8SF6B12二、价层电子对互斥理论价层电子对互斥理论(VSEPR)认为,分子的立体构型是“价层电子对”相互排斥的结果。价层电子对是指中心原子上的电子对,包括σ键电子对和中心原子上的孤电子对。σ键电子对:孤电子对:原子之间共用的一对电子原子中未与其它原子共用的一对电子O为中心原子,周围的四对电子为价层电子对;其中H与O共用的电子对为σ键电子对,未与其它原子共用的电子对为孤电子对。H:O:....H价层电子对排斥力大小:孤对电子对-孤对电子对>孤对电子对-σ键电子对>σ键电子对-σ键电子对孤电子对=(a-xb)12a为中心原子的价电子数;x为中心原子结合的原子数;b为中心原子结合的原子最多能接受的电子数,即(8-该原子的价电子数)(H为2-1=1)σ键电子对=中心原子所连原子数分子中心原子axb中心原子上的孤电子对σ键电子对价层电子对CH4NH3H2OCO2SO3OCN4CS41053116212422063204332244423离子中心原子axb中心原子上的孤电子对σ键电子对价层电子对NH4+CO32-NO3-SO32-NNC4S41063206320832143334334离子中,中心原子上的价电子数:阳离子:原子的价电子数-离子的电荷数阴离子:原子的价电子数+离子的电荷数略去VSEPR模型中的中心原子上的孤电子对,便可得到分子或离子的立体构型。平面三角形,电子对之间的夹角为120°直线形,电子对之间的夹角为180°正四面体形,电子对之间的夹角为109°28′价层电子对模型(VSEPR模型)名称:价层电子对数=2:价层电子对数=3:价层电子对数=4:σ键电子对和孤电子对之间的排斥力大小不同,所以VSEPR模型相同的分子或离子的立体构型中,键角的大小也不一定相同。VSEPR模型相同,分子或离子的立体构型不一定相同。VSEPR模型与价层电子对有关,分子或离子的立体构型与σ键电子对有关。VSEPR模型与立体构型价层电子对σ键电子对孤电子对VSEPR模型名称立体构型名称键角233444203002143212直线形正四面体形直线形平面三角形平面三角形平面三角形V形正四面体形正四面体形正四面体形三角锥形V形180°小于120°120°小于109°28′109°28′ABnA中σ键电...