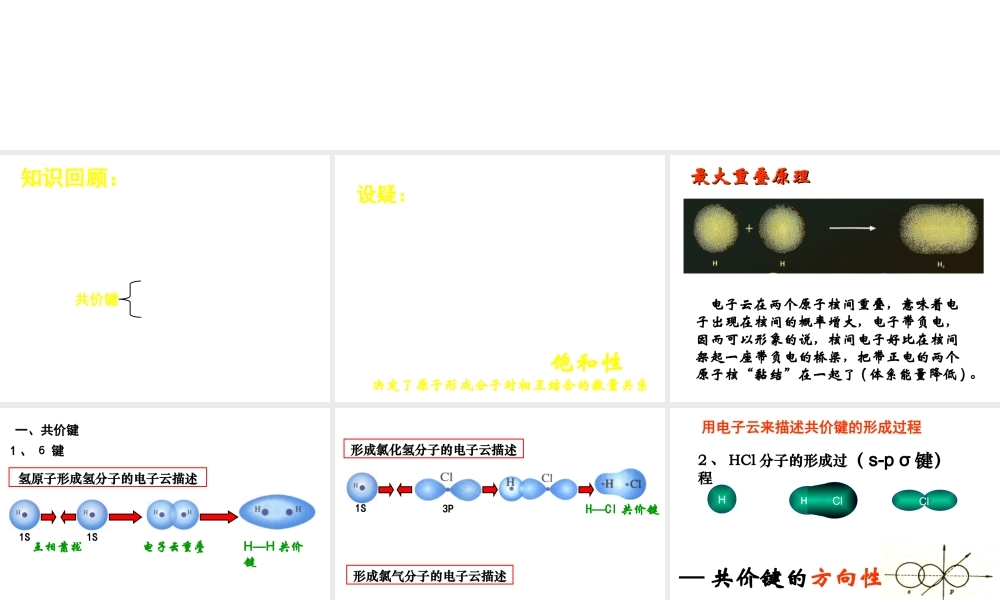
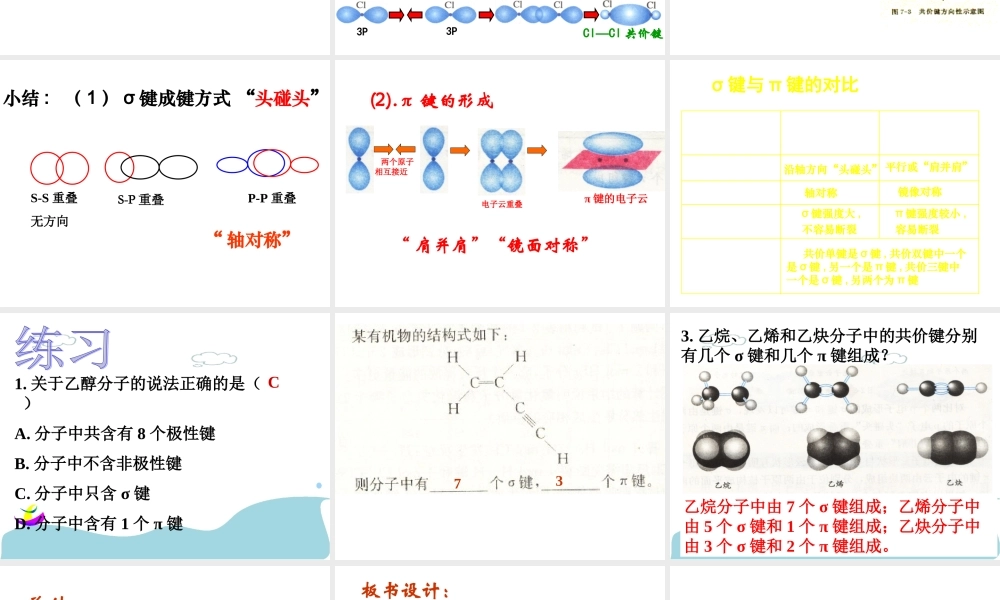
选修三:物质结构与性质第一课时知识回顾:1、什么是共价键?2、通常哪些元素之间可以形成共价键?3、共价键是如何形成的?类型:共价键极性共价键非极性共价键4、用电子式表示共价键的形成过程:HCl、Cl2设疑:为什么稀有气体元素的分子都是单原子分子,而氢分子、氯分子是双原子分子?氢原子为什么会与氧原子按照2:1的原子个数比结合成稳定的水分子而不是其他比例呢?有没有可能存在H3、Cl3、H2Cl分子?为什么?——共价键具有饱和性决定了原子形成分子时相互结合的数量关系电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了(体系能量降低)。最大重叠原理最大重叠原理一、共价键1S1S互相靠拢电子云重叠H—H共价键氢原子形成氢分子的电子云描述1、б键形成氯化氢分子的电子云描述1S3PH—Cl共价键3P3PCl—Cl共价键形成氯气分子的电子云描述2、HCl分子的形成过程HCl用电子云来描述共价键的形成过程ClH—共价键的方向性(s-pσ键)S-S重叠无方向S-P重叠P-P重叠小结:(1)σ键成键方式“头碰头”“轴对称”(2).π键的形成两个原子相互接近电子云重叠π键的电子云“肩并肩”“镜面对称”σ键π键成键方向电子云形状牢固程度成键判断规律项目键型σ键与π键的对比沿轴方向“头碰头”平行或“肩并肩”轴对称镜像对称σ键强度大,不容易断裂π键强度较小,容易断裂共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键1.关于乙醇分子的说法正确的是()A.分子中共含有8个极性键B.分子中不含非极性键C.分子中只含σ键D.分子中含有1个π键C733.乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?乙烷分子中由7个σ键组成;乙烯分子中由5个σ键和1个π键组成;乙炔分子中由3个σ键和2个π键组成。总结:共价键:原子之间通过共用电子对所形成的相互作用。1.共价键的性质:饱和性,方向性2.共价键的常见类型:σ键“头碰头”(s-s、s-p、p-p)π键“肩并肩”(p-p)板书设计:第二章分子结构与性质第一节共价键(第一课时)1.共价键的性质:饱和性,方向性2.共价键的常见类型:σ键“头碰头”(s-s、s-p、p-p)轴对称π键“肩并肩”(p-p)镜面对称3.成键规律:共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键反思与感悟1.教师引导下的自主探究是本节课突出...