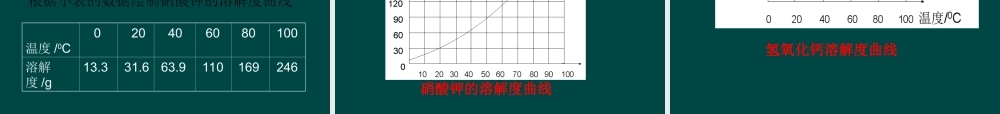
一、影响物质溶解性的因素二、物质溶解性的定量表示三、溶解度曲线四、结晶思考:为什么在相同的条件下,面粉在水中不易溶解,而食盐易溶于水中;为什么油渍在水中很难溶解,在汽油中却很容易溶解?动手在2支试管的水中分别加入食盐和食用油。思考为什么会有不同的结果出现?这说明物质的溶解和本身溶质的性质及溶剂的性质有关。探究并思考:一种物质(溶质)溶解在另一种物质(溶剂)里的能力称为溶解性。影响物质溶解性的因素还有哪些呢?探究实验一探究实验二探究实验一:实验一在水中食盐和蔗糖溶解的多,熟石灰溶解的少。实验二油渍在水中不溶解,在汽油中溶解。实验三硝酸钾加热之前不能全部溶解,加热后全部溶解。1、不同的物质同一溶剂中溶解性的不同。2、同一种物质在不同溶剂中的溶解能力不同。3、同一种物质在同一种溶剂中的溶解能力与温度有关。探究实验二:实验一硝酸钠在水中的溶解有极限。实验二加水后硝酸钠继续溶解。实验三加热后硝酸钠继续溶解。1、配制硝酸钠溶液时,用水越多,溶解的硝酸钠溶质越多;2、温度升高时,大多数物质在一定量水中所能溶解的量也越多。定义:在一定的温度下,一定量的溶剂里,不能在溶解的某种溶质的溶液,叫做这种溶质的饱和溶液。能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。能否继续溶解原溶液溶液的“浓”、“稀”相对比较饱和溶液不饱和溶液不能能浓稀同温度,同溶质、溶剂的饱和溶液和不饱和溶液的比较饱和溶液不饱和溶液饱和溶液变成不饱和溶液:加热、加溶剂等不饱和溶液变成饱和溶液:降温、增加溶质、减少溶剂(如蒸发)等注:以上为通常情况,不适合所有的物质。练习:有两瓶KNO3溶液,一瓶是20℃饱和溶液,一瓶是20℃不饱和溶液,如何确定哪一瓶是饱和溶液?通过哪些途径能将KNO3溶液的饱和溶液转化成不饱和溶液?探究实验三:向两份10g水中分别加入2克食盐和0.2克熟石灰,观察现象。现象:食盐全部溶解,熟石灰不能全部溶解结论:食盐是不饱和溶液,但它是浓溶液;熟石灰溶液是稀溶液,但它是饱和溶液饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。在相同温度下,同种溶质的饱和溶液比它的不饱和溶液要浓。结论:固体物质的溶解度是指在一定的温度下,该物质在100g溶剂(通常溶剂为水)里达到饱和状态时所溶解的克数。溶解度用来定量描述物质的溶解性强弱。定义分析:条件一定温度状态饱和状态溶剂100克单位克溶解度的表示:(用S表示)例如:20℃时SNaCl=36g在20℃时,...