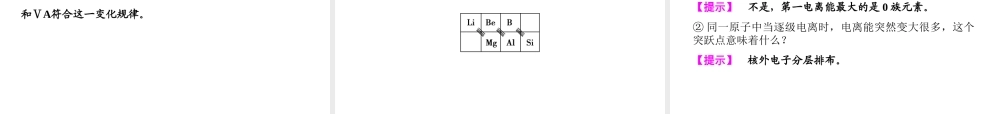
教师用书独具演示第2课时元素周期律●课标要求能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。●课标解读1.掌握元素电离能的涵义,并能应用元素的电离能说明元素的某些性质。2.理解电负性的涵义,并能依据电负性判断某些元素的金属性和非金属性的强弱。●教学地位本课时是在必修2物质结构与元素周期律的基础上进一步的深化,电离能、电负性的概念及其应用是本章的重点和难点,也是高考选修部分的必考点。●新课导入建议在必修2,我们学习了元素周期表中同周期主族元素从左到右,原子半径的变化趋势,应如何理解这种趋势?元素周期表中同主族元素从上到下,原子半径的变化趋势,应如何理解这种趋势?在必修2,学习了元素周期律,这一节我们还要学习元素周期律的另外两个规律——电离能、电负性。●教学流程设计演示结束课标解读重点难点1.了解元素电离能、电负性的含义。2.能应用元素的电离能说明元素的某些性质。3.了解原子半径、第一电离能、电负性的周期性变化。4.了解元素的“对角线”规则,能列举实例予以说明。1.能准确掌握原子半径、第一电离能的周期性变化的规律。(重点)2.掌握ⅡA、ⅤA元素电离能数值不符合变化规律的影响因素。(难点)3.能用电负性数值判断简单化合物中化学键类型。(重难点)2.电离能(1)概念基态原子失去一个电子转化为态基态正离子所需要的叫做第一电离能。(2)变化规律①同一周期从左到右:第一电离能有逐渐的趋势;②同族元素从上到下第一电离能逐渐。气态电中性气最低能量增大减小1.M(g)――→-2e-M2+(g)所需的能量是否是其第一电离能的2倍?【提示】不是,应远大于其第一电离能的2倍。因为首先失去的电子是能量最高的电子,故第一电离能最小,再失去的电子是能量较低的电子,且失去电子后离子所带正电荷对电子吸引力更强,从而使电离能越来越大。1.电负性2.同一周期从左到右,ⅡA和ⅤA的第一电离能不符合变化规律,ⅡA和ⅤA的电负性符合变化规律吗?【提示】同一周期从左到右,电负性逐渐增大,ⅡA和ⅤA符合这一变化规律。2.对角线规则在元素周期表中,某些主族元素与的主族元素的电负性接近,性质相似,被称为“对角线规则”。右下方【问题导思】①在同一周期中ⅦA族的第一电离能最大吗?【提示】不是,第一电离能最大的是0族元素。②同一原子中当逐级电离时,电离能突然变大很多,这个突跃点意味着什么?【提示】核外电子分层排布。1.第一电离能(1)每个周期的第一种元素(氢和碱金...