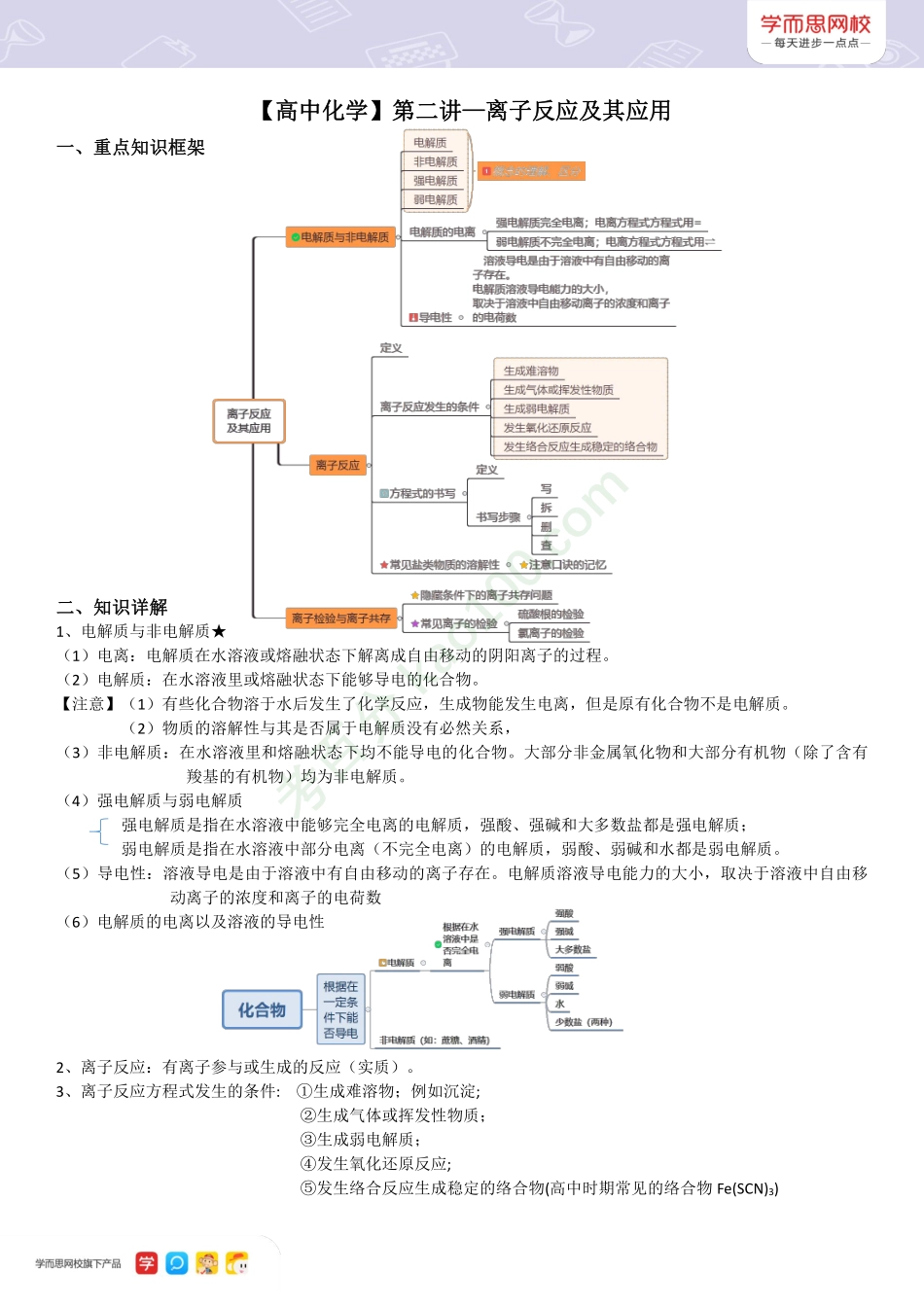
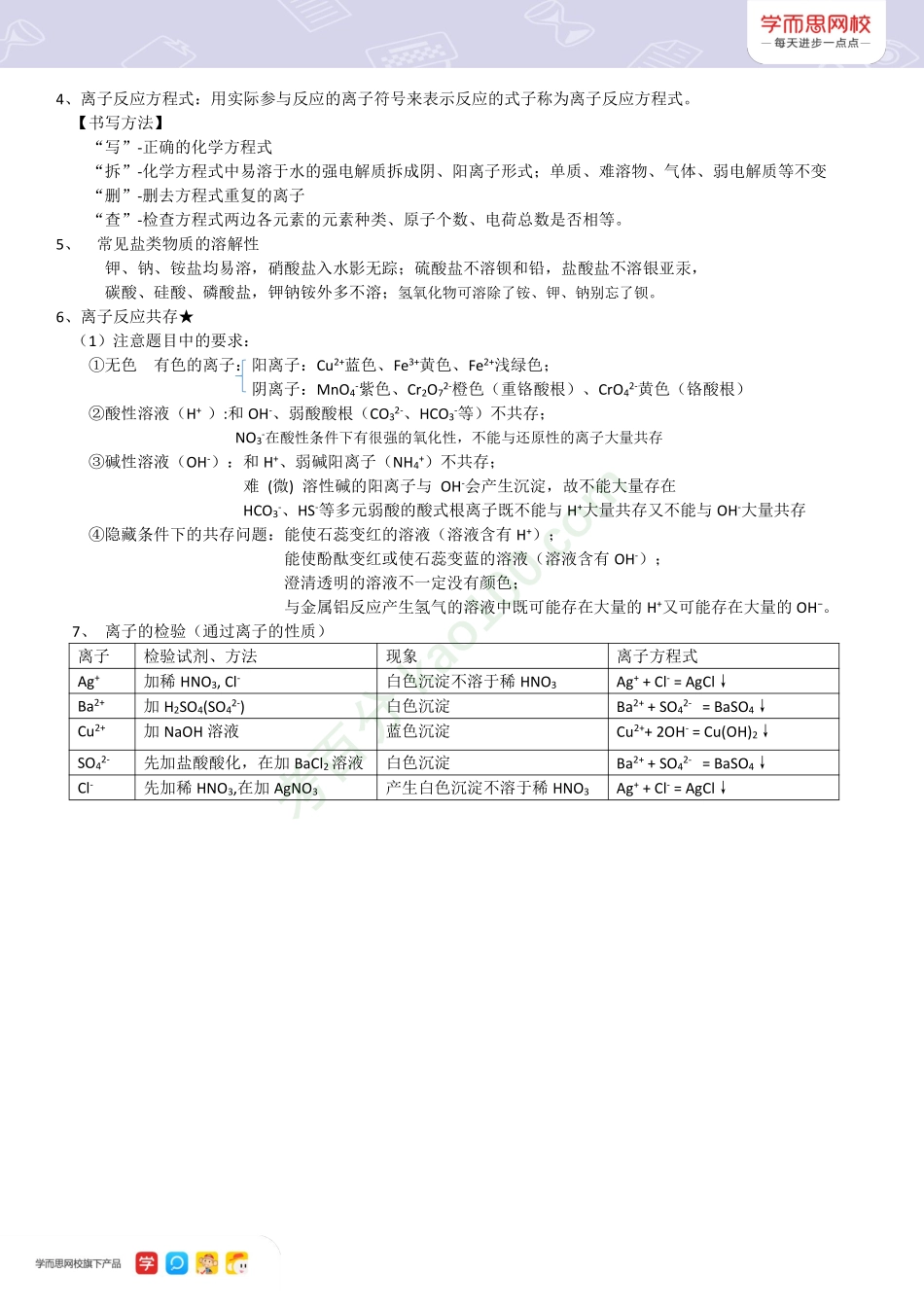
【高中化学】第二讲—离子反应及其应用一、重点知识框架二、知识详解1、电解质与非电解质★(1)电离:电解质在水溶液或熔融状态下解离成自由移动的阴阳离子的过程。(2)电解质:在水溶液里或熔融状态下能够导电的化合物。【注意】(1)有些化合物溶于水后发生了化学反应,生成物能发生电离,但是原有化合物不是电解质。(2)物质的溶解性与其是否属于电解质没有必然关系,(3)非电解质:在水溶液里和熔融状态下均不能导电的化合物。大部分非金属氧化物和大部分有机物(除了含有羧基的有机物)均为非电解质。(4)强电解质与弱电解质强电解质是指在水溶液中能够完全电离的电解质,强酸、强碱和大多数盐都是强电解质;弱电解质是指在水溶液中部分电离(不完全电离)的电解质,弱酸、弱碱和水都是弱电解质。(5)导电性:溶液导电是由于溶液中有自由移动的离子存在。电解质溶液导电能力的大小,取决于溶液中自由移动离子的浓度和离子的电荷数(6)电解质的电离以及溶液的导电性2、离子反应:有离子参与或生成的反应(实质)。3、离子反应方程式发生的条件:①生成难溶物;例如沉淀;②生成气体或挥发性物质;③生成弱电解质;④发生氧化还原反应;⑤发生络合反应生成稳定的络合物(高中时期常见的络合物Fe(SCN)3)考百分kao100.com4、离子反应方程式:用实际参与反应的离子符号来表示反应的式子称为离子反应方程式。【书写方法】“写”-正确的化学方程式“拆”-化学方程式中易溶于水的强电解质拆成阴、阳离子形式;单质、难溶物、气体、弱电解质等不变“删”-删去方程式重复的离子“查”-检查方程式两边各元素的元素种类、原子个数、电荷总数是否相等。5、常见盐类物质的溶解性钾、钠、铵盐均易溶,硝酸盐入水影无踪;硫酸盐不溶钡和铅,盐酸盐不溶银亚汞,碳酸、硅酸、磷酸盐,钾钠铵外多不溶;氢氧化物可溶除了铵、钾、钠别忘了钡。6、离子反应共存★(1)注意题目中的要求:①无色有色的离子:阳离子:Cu2+蓝色、Fe3+黄色、Fe2+浅绿色;阴离子:MnO4-紫色、Cr2O72-橙色(重铬酸根)、CrO42-黄色(铬酸根)②酸性溶液(H+):和OH-、弱酸酸根(CO32-、HCO3-等)不共存;NO3-在酸性条件下有很强的氧化性,不能与还原性的离子大量共存③碱性溶液(OH-):和H+、弱碱阳离子(NH4+)不共存;难(微)溶性碱的阳离子与OH-会产生沉淀,故不能大量存在HCO3-、HS-等多元弱酸的酸式根离子既不能与H+大量共存又不能与OH-大量共存④隐藏条件下的共存问题:能使石蕊变...