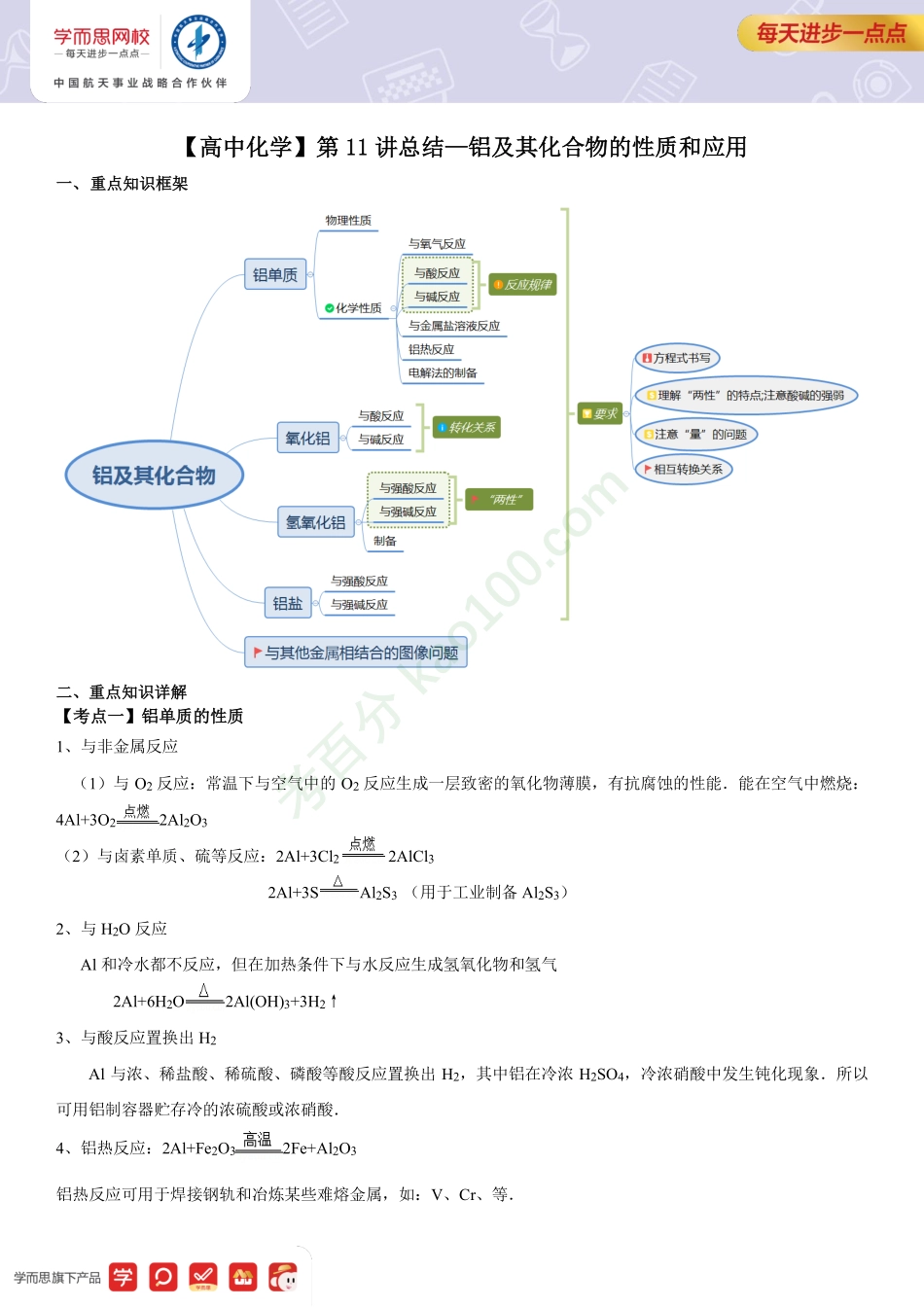
【高中化学】第11讲总结—铝及其化合物的性质和应用一、重点知识框架二、重点知识详解【考点一】铝单质的性质1、与非金属反应(1)与O2反应:常温下与空气中的O2反应生成一层致密的氧化物薄膜,有抗腐蚀的性能.能在空气中燃烧:4Al+3O22Al2O3(2)与卤素单质、硫等反应:2Al+3Cl22AlCl32Al+3SAl2S3(用于工业制备Al2S3)2、与H2O反应Al和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气2Al+6H2O2Al(OH)3+3H2↑3、与酸反应置换出H2Al与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2SO4,冷浓硝酸中发生钝化现象.所以可用铝制容器贮存冷的浓硫酸或浓硝酸.4、铝热反应:2Al+Fe2O32Fe+Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等.考百分kao100.com[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、MnO2等.②铝热反应的特点是反应放出大量的热,使生成的金属呈液态.③要使用没有氧化的铝粉,氧化铁粉末要烘干.④KClO3作为引燃剂,也可以用Na2O2代替.实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃.5、与碱反应:2Al+2NaOH+6H2O=2NaAlO2+4H2O+3H2↑【经典例题】例1在给定条件下,下列选项所示的物质间转化均能实现的是()A.AlAl(OH)3NaAlO2B.SiO2(s)SiCl4(l)Si(s)C.NH3NOHNO3D.石油CH2=CH2CH2BrCH2Br例2下列关于铝及其化合物的说法,不正确的是()A.铝是地壳中含量最多的金属元素,自然界中铝以稳定化合态存在B.铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定C.常温下,铝遇浓硝酸、浓硫酸时会在表面生成致密的氧化物膜而发生钝化D.向氯化铝溶液中滴加饱和NaF溶液,再滴加氨水,振荡后,没有观察到白色沉淀【考点二】铝的氧化物Al2O3是难溶于水的白色固体,离子化合物,熔点高,化学性质活泼,可作为耐火材料;是两性氧化物,既可以和酸反应,又可以和碱反应:Al2O3+6HCl=2AlCl3+3H2O;Al2O3+2NaOH=2NaAlO2+H2O【考点三】铝的氢氧化物和常见的铝盐1、Al(OH)3:不溶于水的白色胶状物质;能凝聚水中的悬浮物,可用作净水剂、可治疗胃酸过多、作糖的脱色剂等;考百分kao100.com既能与酸反应,又能与碱反应.化学性质:(1)与酸反应:Al(OH)3+3H+═Al3++3H2O(2)与碱反应:Al(OH)3+OH﹣═AlO2﹣+2H2O(3)受热易分解:2Al(OH)3Al2O3+3H2O2、氢氧化铝的制备:实验室制法:Al2(S...