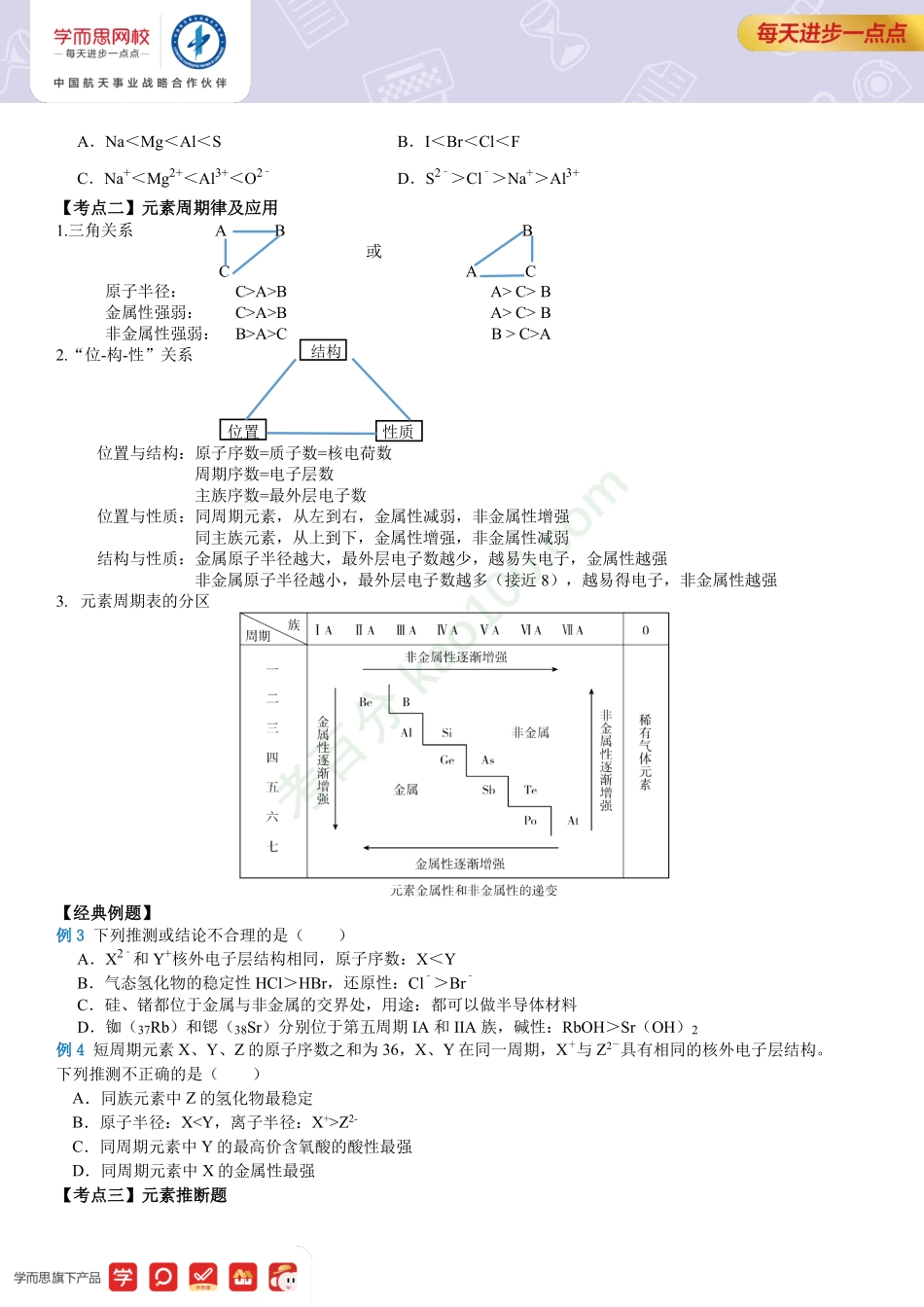
【高中化学】第十五讲总结—元素周期律及应用一、重点知识框架二、重点知识详解【考点一】元素性质的变化规律以及半径比较1.元素周期律元素性质同周期的主族元素(左→右)同主族元素(上→下)电子层数相同逐渐增多最外层电子数逐渐增多(1e-→7e-)相同原子半径逐渐减小逐渐增大主要化合价最高正价逐渐增大(+1→+7)最低负价=主族序数-8(金属除外)最高正价、最低负价相同最高正价=主族序数(除F、O外)最高价氧化物对应水化物的酸碱性碱性逐渐减弱酸性逐渐增强酸性逐渐减弱碱性逐渐增强非金属元素气态氢化物的稳定性逐渐增强逐渐减弱元素单质的得失电子能力失e-能力逐渐减弱得e-能力逐渐增强得e-能力逐渐减弱失e-能力逐渐增强元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强非金属性逐渐减弱金属性逐渐增强2.微粒半径比较“三看”:一看电子层数:电子层数不同时,一般情况下,层数越多,半径越大。二看核电荷数:电子层数相同时,核电荷数越大,半径越小。三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。核外电子数和核电荷数都不同的微粒:可通过一种参照物进行比较,如比较Al3+与S2-的半径大小,可以找出与Al3+电子数相同,与S同主族的氧元素的阴离子O2-进行比较,半径:Al3+A>BA>C>B金属性强弱:C>A>BA>C>B非金属性强弱:B>A>CB>C>A2.“位-构-性”关系位置性质位置与结构:原子序数=质子数=核电荷数周期序数=电子层数主族序数=最外层电子数位置与性质:同周期元素,从左到右,金属性减弱,非金属性增强同主族元素,从上到下,金属性增强,非金属性减弱结构与性质:金属原子半径越大,最外层电子数越少,越易失电子,金属性越强非金属原子半径越小,最外层电子数越多(接近8),越易得电子,非金属性越强3.元素周期表的分区【经典例题】例3下列推测或结论不合理的是()A.X2﹣和Y+核外电子层结构相同,原子序...