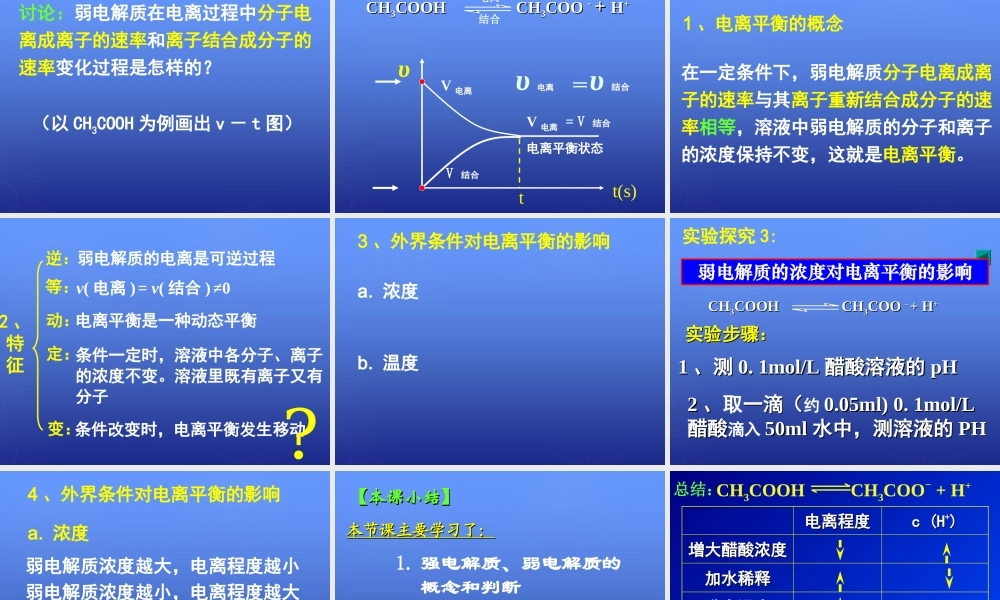
第三章水溶液中的离子平衡第一节弱电解质的电离知识查询:知识查询:pH=-lgc(H+)cc(H(H++)/mol)/mol··LL-1-1pHpH110.10.10.010.010.0010.00111002233PH值与溶液中c(H+)的定量关系总结:溶液中c(H+)稀释到原来的十分之一,PH值增加一个单位。知识回顾:知识回顾:电解质:非电解质:在水溶液中或熔化状态下能够导电的化合物。如如盐酸、、醋酸、氢氧化钠、氯化钠等。在水溶液和熔化状态下都不能导电的化合物。如酒精、蔗糖等如酒精、蔗糖等。。思考:盐酸与醋酸是生活中常用的酸,醋酸可以食用,盐酸常用于卫生洁具的清洁和去除水垢,为什么不用醋酸代替盐酸呢?问题:等浓度的盐酸、醋酸溶液中的H+浓度的大小关系如何?你能设计实验验证你的猜想吗?实验探究1:对比实验:等体积、等浓度的盐酸、醋酸与等量镁条的反应。实验要点:盐酸和醋酸浓度均为1mol/L;镁条用砂纸打磨、长度相同(表面积相同);观察、比较气球鼓起的快慢等现象。实验探究1:对比实验:等体积、等浓度的盐酸、醋酸与等量镁条的反应。实验要点:盐酸和醋酸浓度均为1mol/L;镁条用砂纸打磨、长度相同(表面积相同);观察、比较气球鼓起的快慢等现象。等浓度的盐酸中c(H+)比醋酸大。对实验现象的解释:对实验现象的解释:实验探究2:用pH试纸测定0.1mol/L的盐酸、醋酸pH。盐酸、醋酸电离程度不同。盐酸完全电离,醋酸不完全电离,电离程度较小。结论:强电解质强电解质:在水中能够:在水中能够全部电离全部电离成离成离子的电解质。如子的电解质。如强酸、强碱、大部分强酸、强碱、大部分的盐。的盐。弱电解质弱电解质:能够:能够部分电离部分电离成离子的电成离子的电解质。如解质。如弱酸、弱碱、水弱酸、弱碱、水。。概念:一、强弱电解质一、强弱电解质练习:下列物质属于强电解质的是______,属于弱电解质的是______a.HClb.NaClc.CH3COOHd.BaSO4e.NaOHf.Cu(OH)2g.NH3.H2Oh.H2Ocfghabde练习练习请写出下列物质的电离方程式:(1)NH3·H2O(2)H2CO3(3)Fe(OH)2、弱电解质电离方程式的书写:弱电解质的电离是可逆的;书写电离方程式时用,多元弱酸是分步电离的,以第一步电离为主。金属氢氧化物电离一步写出。CHCH33COOHCOOHCHCH33COOCOO--+H+H++NH3·H2ONH4++OH-H2CO3H++HCO3-HCO3-H++CO32-Fe(OH)3Fe3++3OH-讨论:弱电解质在电离过程中分子电离成离子的速率和离子结合成分子的速率变化过程是怎样的?(以CH3COOH为例画出v-t图)V电离V结合V电离=V结合电离平衡状态υ电离υ结合=tt(s)υCHCH...