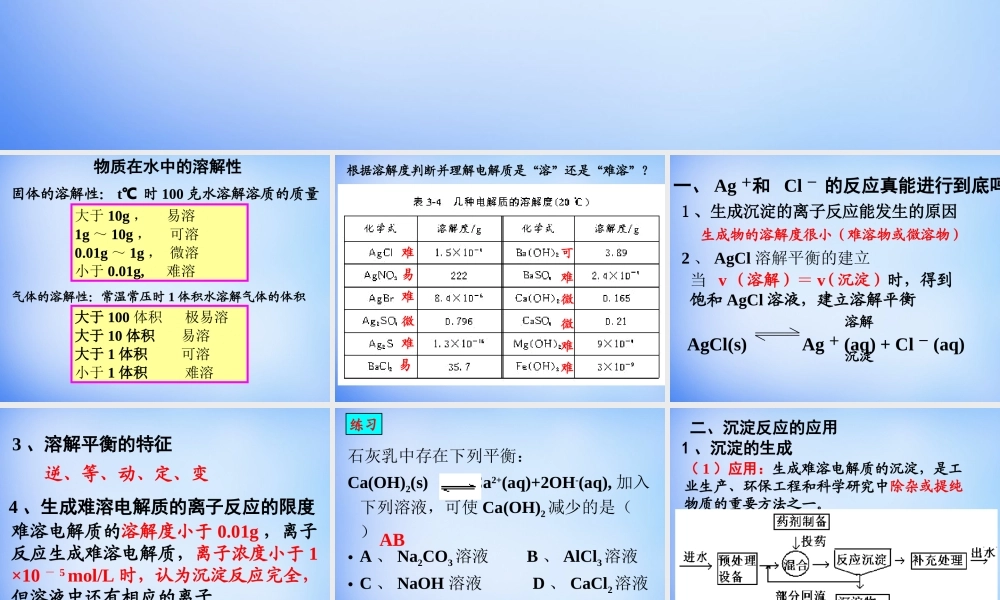
第三章水溶液中的离子平衡第四节第四节难溶电解质的溶解平衡大于10g,易溶1g~10g,可溶0.01g~1g,微溶小于0.01g,难溶物质在水中的溶解性固体的溶解性:t℃时100克水溶解溶质的质量气体的溶解性:常温常压时1体积水溶解气体的体积大于100体积极易溶大于10体积易溶大于1体积可溶小于1体积难溶可难难难难难难微微微易易根据溶解度判断并理解电解质是“溶”还是“难溶”?1、生成沉淀的离子反应能发生的原因生成物的溶解度很小(难溶物或微溶物)2、AgCl溶解平衡的建立当v(溶解)=v(沉淀)时,得到饱和AgCl溶液,建立溶解平衡溶解AgCl(s)Ag+(aq)+Cl-(aq)沉淀一、Ag+和Cl-的反应真能进行到底吗3、溶解平衡的特征逆、等、动、定、变4、生成难溶电解质的离子反应的限度难溶电解质的溶解度小于0.01g,离子反应生成难溶电解质,离子浓度小于1×10-5mol/L时,认为沉淀反应完全,但溶液中还有相应的离子。石灰乳中存在下列平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq),加入下列溶液,可使Ca(OH)2减少的是()•A、Na2CO3溶液B、AlCl3溶液•C、NaOH溶液D、CaCl2溶液AB练习二、沉淀反应的应用1、沉淀的生成(1)应用:生成难溶电解质的沉淀,是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。(2)方法a、调pH值如:工业原料氯化铵中混有氯化铁,加氨水调pH值至7-8Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+b、加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、H2S做沉淀剂Cu2++S2-=CuS↓Hg2++S2-=HgS↓2、沉淀的溶解(1)原理设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动(2)举例a、难溶于水的盐溶于酸中如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸沉淀不溶解沉淀溶解沉淀溶解Mg(OH)2+2HCl=MgCl2+2H2OMg(OH)2+2NH4Cl=MgCl2+2NH3+2H2Ob、难溶于水的电解质溶于某些盐溶液如:Mg(OH)2溶于NH4Cl溶液思考与交流用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因Mg(OH)2+2NH4Cl=MgCl2+2NH3+2H2OMg(OH)2(s)Mg²+2OHˉ+2NH4+2H2O2NH3·H2O+2H++2H2O+可能原因②Mg(OH)2(s)Mg²+2OHˉ2NH4Cl=2Clˉ+2NH42NH3·H2O+++可能原因①2AgI(s)2Ag+2IˉS²ˉAg2S↓++产生白色沉淀白色沉淀变黄色黄色沉淀变黑色AgNO3+NaCl=AgCl↓(白色)+NaNO3AgCl+KI=AgI↓(黄色)+KCl2AgI+Na2S=Ag2S↓(黑色)+2NaIAgCl(s)Ag+ClˉIˉAgI↓++产生白色沉淀白色沉淀变红褐色出现红褐色沉淀MgCl2+2NaOH=Mg(OH)2↓(白色)+2NaCl...