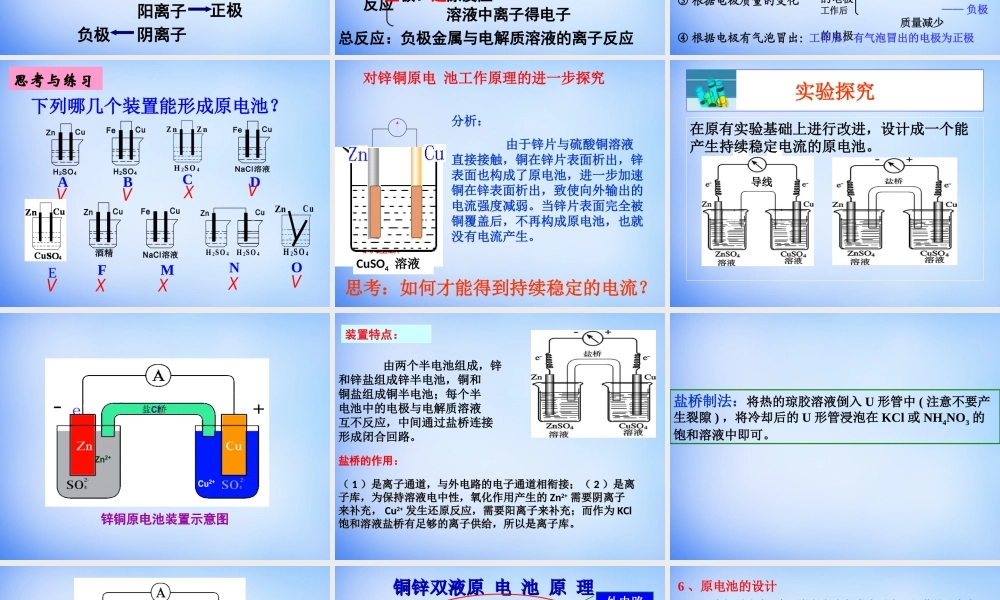
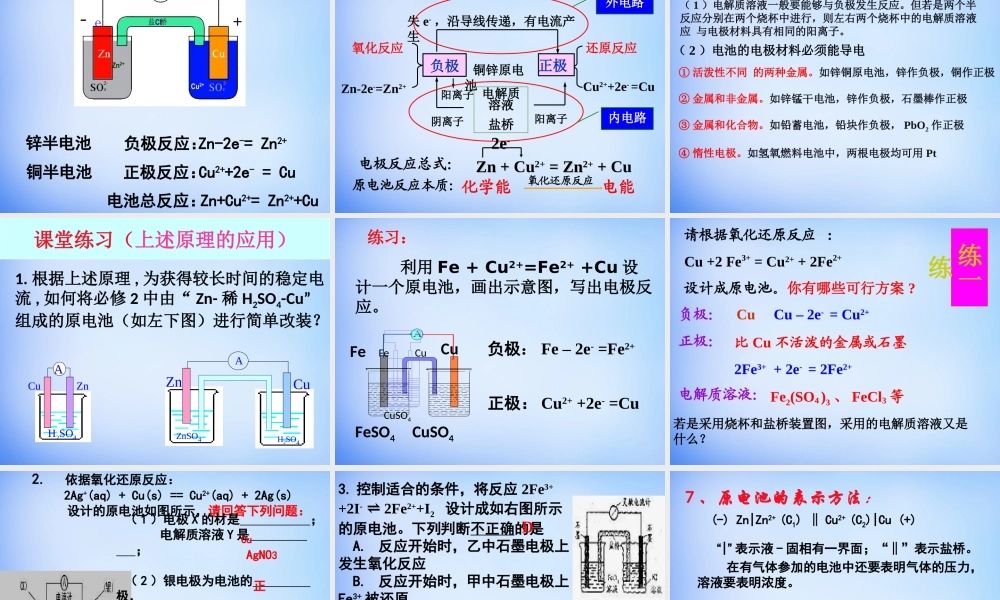
第四章电化学基础第一节原电池电化学:指研究化学能与电能之间相互转换的装置、过程和效率的科学。过程及装置分按电化学反应2.借助电流而发生反应及装置(如:电解池){1.产生电流的化学反应及装置(如:原电池等)11、原电池的定义:、原电池的定义:22、原电池反应的本质:、原电池反应的本质:33、构成原电池的条件:、构成原电池的条件:将化学能转化为电能的装置叫做原电池。将化学能转化为电能的装置叫做原电池。氧化还原反应氧化还原反应①①两个两个活动性不同的金属(或其中一种为非金属,即作导体用)作电极。②②电解质溶液电解质溶液③③形成闭合回路形成闭合回路④④在这种电解质溶液中能自发地进行氧化还原在这种电解质溶液中能自发地进行氧化还原反应反应CuZn稀硫酸-Zn2+H+H+灯泡Zn-2e-=Zn2+负极负极正极正极2H++2e-=H2↑总反应式:Zn+2H+=Zn2++H2↑负负正氧化反应还原反应现象:锌棒溶解,铜棒上有气泡原电池工作原理CuZn-Zn2+H+H+负极正极阳离子阴离子正极负极SO42-原电池工作原理Ae-4、原电池反应原理①粒子流向电子:负极→正极电流:正极→负极溶液中阴离子→负极溶液中阳离子→正极②电极反应负极:氧化反应活泼金属失电子变阳离子正极:还原反应溶液中离子得电子总反应:负极金属与电解质溶液的离子反应5、原电池的正负极的判断方法微观判断(根据电子流动方向)电子流出的极电子流入的极——负极——正极较活泼的电极材料较不活泼的电极材料质量增加的电极工作后质量减少的电极——负极——正极——正极——负极工作后,有气泡冒出的电极为正极发生氧化反应的极发生还原反应的极宏观判断:①根据电极材料②根据原电池电极发生的反应③根据电极质量的变化④根据电极有气泡冒出:——负极——正极CuFeH2SO4CuZnH2SO4CuFeNaCl溶液CuFeNaCl溶液CuZn酒精CuZnH2SO4H2SO4ABCDEFMnZnZ4OS2HNuC4OS2H下列哪几个装置能形成原电池?OVXVVXXXVV思考与练习CuSO4溶液思考:如何才能得到持续稳定的电流?分析:由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,进一步加速铜在锌表面析出,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。对锌铜原电池工作原理的进一步探究导线在原有实验基础上进行改进,设计成一个能产生持续稳定电流的原电池。实验探究锌铜原电池装置示意图由两个半电池组成,锌和锌盐组成锌半电池,铜和铜盐组成铜半电池;每个半电池中的电极与电解质溶液...