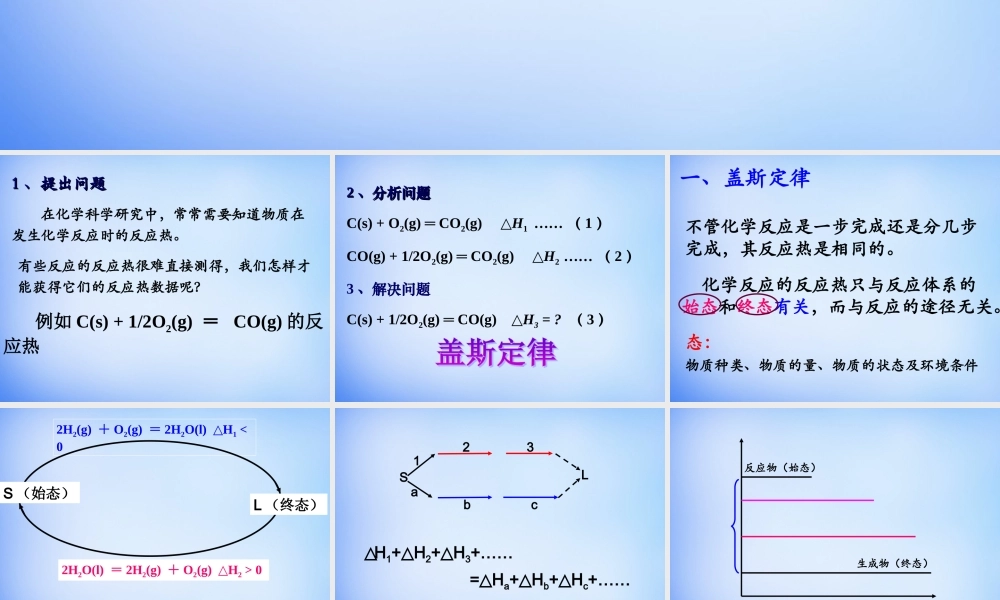
第一章化学反应与能量第三节化学反应热的计算11、提出问题、提出问题在化学科学研究中,常常需要知道物质在发生化学反应时的反应热。例如C(s)+1/2O2(g)=CO(g)的反应热有些反应的反应热很难直接测得,我们怎样才能获得它们的反应热数据呢?22、分析问题、分析问题C(s)+O2(g)═CO2(g)△H1……(1)CO(g)+1/2O2(g)═CO2(g)△H2……(2)3、解决问题C(s)+1/2O2(g)═CO(g)△H3=?(3)一、盖斯定律不管化学反应是一步完成还是分几步完成,其反应热是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。态:物质种类、物质的量、物质的状态及环境条件2H2O(l)=2H2(g)+O2(g)H△2>02H2(g)+O2(g)=2H2O(l)H△1<0S(始态)L(终态)△H1+H△2≡0SL123abc△H1+H△2+H△3+……=H△a+H△b+H△c+……反应物(始态)生成物(终态)即无论经过什么途径,由C(s)+O2(g)变成CO2(g)的反应热是定值。△H=H△1+H△2C(s)CO2(g)CO(g)图示法外,还可用什么方法解决?图示法C(s)+1/2O2(g)==CO(g)H△3=?CO(g)+1/2O2(g)=CO2(g)H△2=-283.0kJ/molC(s)+O2(g)=CO2(g)H△1=-393.5kJ/mol-)∴△H3=H△1-△H2=-393.5kJ/mol-(-283.0kJ/mol)=-110.5kJ/mol(1)-(2)=(3)•通过实验无法直接测定C(s)+1/2O2(g)=CO(g)反应热有些反应进行得很慢,有些反应不容易发生,有些反应的产品不纯盖斯定律的数学本质:热化学方程式按一定系数关系的相加减下列数据表示H2的燃烧热吗?H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/molH2O(g)=H2O(l)△H2=-44kJ/mol已知H2(g)+1/2O2(g)=H2O(l)△H=△H1+△H2=-例1:写出石墨变成金刚石的热化学方程式(25,101kPa℃时)•说明:(1)可以在书中P7查找需要的数据•(2)并告诉大家你设计的理由。先思考,之后小组讨论汇报查燃烧热表知:①C(石墨,s)+O2(g)==CO2(g)H△1=-393.5kJ/mol②C(金刚石,s)+O2(g)==CO2(g)H△2=-395.0kJ/mo所以,①-②得:C(石墨,s)=C(金刚石,s)H=+1.5kJ/mol△观察该热化学方程式,回答:金刚石能自动变成石墨吗?需要什么条件?你知道神六的火箭燃料是什么吗?例2:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:①N2(g)+2O2(g)==2NO2(g)H△1=+67.2kJ/mol②N2H4(g)+O2(g)==N2(g)+2H2O(l)H△2=-534kJ/mol假如都在相同状态下,请写出发射火箭反应的热化学方程式。2N2H4(g)+2NO2(g)==3N2(g)+4H2O(l)H=-1135.2kJ/mol△②×2-①得1、请用自己的话描述一下盖斯定律。2、盖斯定律有...