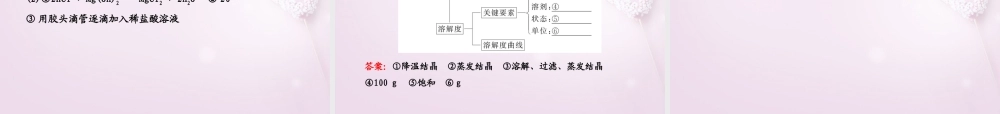
第三单元海水中的化学一、海水中的物质1.海水制镁(1)流程。(2)原理:MgCl2+Ca(OH)2====Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl====MgCl2+2H2O,MgCl2Mg+Cl2↑。通电====2.海水晒盐(1)流程。(2)原理:蒸发结晶。3.海水制碱(1)流程。(2)原理。NaCl+H2O+NH3+CO2====NaHCO3+NH4Cl2NaHCO3Na2CO3+H2O+CO2↑△====4.海水淡化(1)膜法。(2)热法——常用的有①低温多效蒸馏法②多级闪急蒸馏法二、结晶与溶解度1.结晶的方法(1)蒸发结晶,适合于溶解度受温度影响变化较小的物质,如NaCl。(2)降温结晶,适合于溶解度受温度影响变化较大的物质,如KNO3。2.粗盐的提纯(1)除去粗盐中难溶性杂质的步骤。①溶解;②过滤;③蒸发结晶。(2)除去食盐晶体中可溶性杂质的方法。①向食盐水中依次加入过量的BaCl2、NaOH和Na2CO3等,将SO42-、Mg2+、Ca2+转化为沉淀,过滤后,再加适量盐酸,除去多余的CO32-和OH-。②蒸发结晶得到精盐。3.溶解度(1)固体溶解度的四个要素。①条件:一定温度②100克溶剂③饱和状态④单位为克。(2)影响因素。①溶质、溶剂本身的性质②温度。4.温度对固体溶解度的影响根据溶解度曲线可分为“三种类型”:(1)“陡升型”——大多数固体物质的溶解度随温度升高而显著增大,如KNO3;(2)“缓升型”——少数固体物质溶解度受温度的影响变化不大,如NaCl;(3)“缓降型”——极少数物质的溶解度随温度的升高而减小,如Ca(OH)2。5.复分解反应(1)基本形式:AB+CD→AD+CB。(2)要求。①两种化合物相互交换成分,生成另外两种化合物。②反应前后各元素(原子团)化合价不变。(3)发生的条件。两种物质在溶液中相互交换离子后,如果生成物中有沉淀析出、气体放出或有水生成,则反应就能够发生。(4)实质:离子之间的互换反应。三、溶解度曲线1.表示横坐标表示温度,纵坐标表示物质的溶解度。体现了物质的溶解度随温度变化而变化的规律。2.应用(以上图为例)(1)查出某物质在一定温度时的溶解度(如物质A在t1温度下的溶解度为a)(2)确定同一物质在不同温度时的溶解度(3)比较不同物质在同一温度下的溶解度(如:物质A、B在t2温度下的溶解度相同)(4)物质的溶解度随温度的变化情况(如A物质的溶解度随温度变化较大;B物质的溶解度随温度变化不大)答案:①MgCl2+Ca(OH)2====Mg(OH)2↓+CaCl2②Mg(OH)2+2HCl====MgCl2+2H2O③MgCl2Mg+Cl2↑④膜法⑤热法⑥可燃冰电解====【专题1】海洋化学资源主要考点:从海水中提取镁的相关反应,海底矿物资源,海水淡化的方法。从...