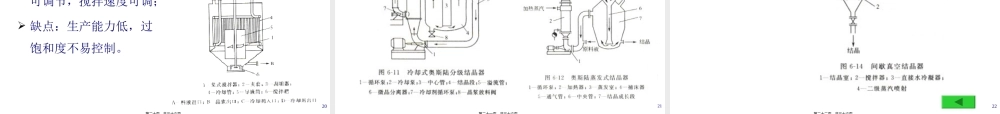
第二(dìèr)部分结晶一、概念二、结晶操作的特点三、结晶基本(jīběn)理论四、晶核生成和晶体生长理论五、结晶溶液的形成及结晶控制六、常用结晶设备七、重结晶1第一页,共三十六页。一、概念(gàiniàn)结晶是固体物质以晶体状态从蒸汽、溶液或熔融(róngróng)物中析出的过程。固体状态:1.结晶:析出速度慢,析出粒子排列有规则;2.无定形:(沉淀)析出速度快,排列无规则;2第二页,共三十六页。二、结晶操作(cāozuò)的特点1.结晶为同类分子或离子进行规则排列的过程,因此结晶具有高选择性;2.结晶后,大部分杂质留在母液中,经过滤、洗涤得纯度(chúndù)高的晶体;3.结晶成本低,设备简单,操作方便,因此应用广泛。广泛应用于氨基酸、有机酸、抗生素、维生素、核酸等产品的精制。3第三页,共三十六页。三、结晶基本(jīběn)理论1.溶解过程、溶解度及其主要影响因素①溶解过程可溶性固体由于分子运动在溶质(róngzhì)和固体的溶剂间进行两种分子扩散:一是分子从固体表面扩散到液体内部;二是从液体内部扩散到固体表面;开始阶段分子向液体内部扩散速率大于从液体内部扩散到固体的速率,表观上处于溶解状态;当两者速率相等时即固液达到平衡状态,表观上固体不再溶解,但实质上处于动态平衡,溶解和结晶在同时进行,只不过速率相同而已。4第四页,共三十六页。②溶解度:一定条件下,100g溶剂溶解(róngjiě)的溶质的量。③影响溶解度的因素A.温度a.一般情况下,温度上升,溶解度上升,只是上升的幅度(fúdù)不同而已。5第五页,共三十六页。b.先增大后减小Na2SO4:开始在水中以结晶水合物的形式存在,之后(zhīhòu)为Na2SO4。c.溶解度随温度升高而降低Ca(OH)2少量的有机物——如螺旋霉素。6第六页,共三十六页。B.PH值大多数药物和大分子有机分子,如:蛋白质、氨基酸等,在其等电点处的溶解度最小,等电点PI=4-6,调节PH值与等电点PI相等可使其溶解度最小。C.离子强度对于有机药物溶液,加入盐的量改变离子强度,也改变了溶质和溶剂间的能量平衡,也会降低药物在溶液中的溶解度。D.压力压力对气体(qìtǐ)物质的溶解度有较大的影响。7第七页,共三十六页。2.过饱和达到固液相平衡时的溶液称为饱和溶液。溶液中含有超过饱和量的溶质称为过饱和溶液(在无扰动、无刺激的条件下降温(jiàngwēn)即可形成)。过饱和度:C-过饱和溶液的浓度;C*-饱和浓度。*CCS8第八页,共三十六页。3.结晶(jiéjīng)溶解相平衡图三区特征:...