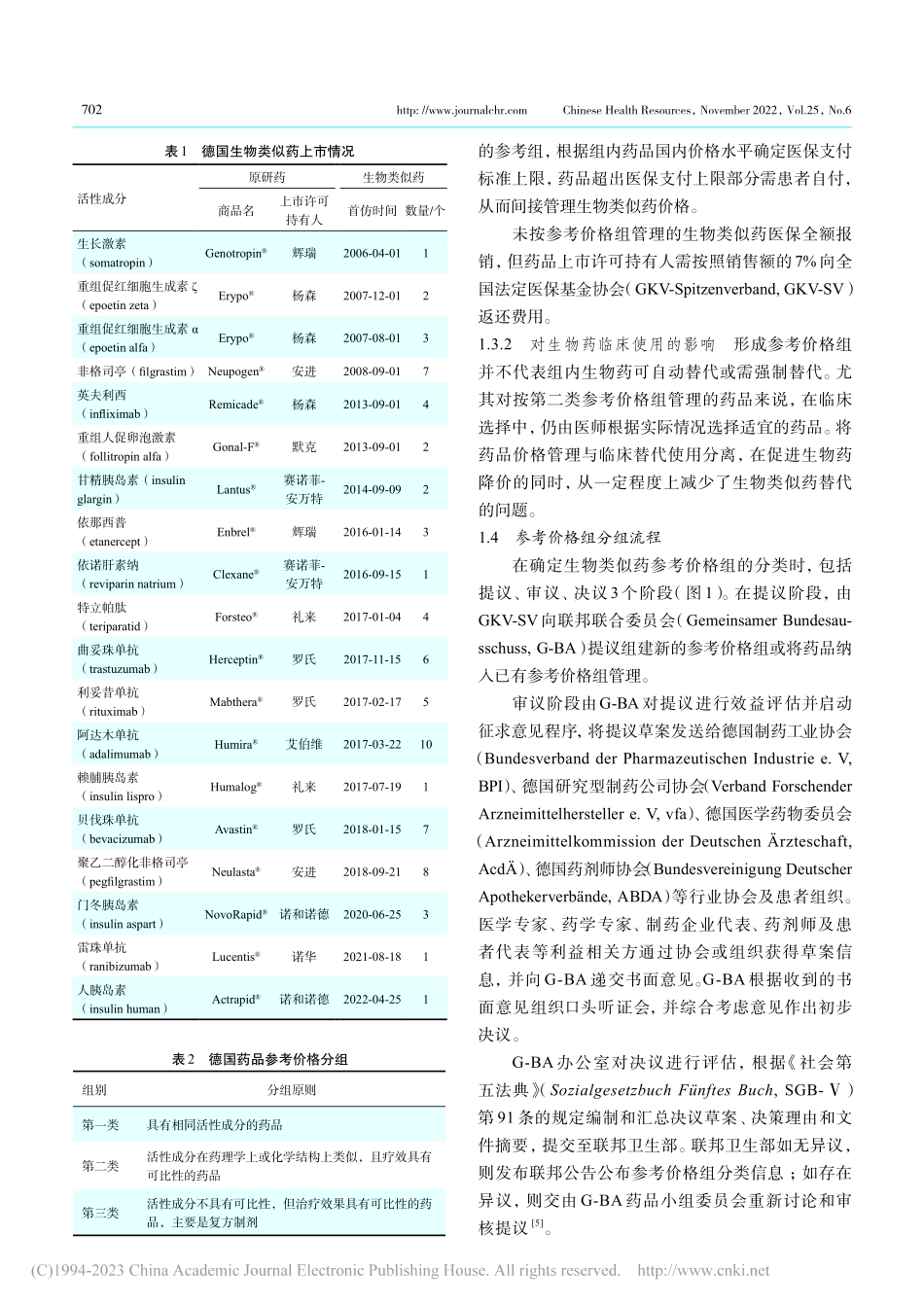
701中国卫生资源2022年11月第25卷第6期http://www.journalchr.com生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品[1]。自2006年欧洲药品管理局(EuropeanMedicinesAgency,EMA)批准全球第一个生物类似药以来,此类药物以较低的价格逐步推动市场竞争、降低生物药费用、提高药品可支付性和可获得性[2]。德国目前已有19个品种的生物类似药上市。生物类似药与化学仿制药定价管理方式相同,均采用参考价格组的形式确定医疗保险(以下简称“医保”)支付标准。价格组结合药品属性、市场竞争等情况,按照活性成分、药理作用、适应证等标准划分,已形成相对成熟的法律依据和实施框架。分组情况体现德国药品管理部门在生物类似药价格管理实践中,对其结构复杂性、免疫原性、与原研药可比性、多适应证等特点的态度和考量。现对德国生物类似药定价分组情况进行案例分析,关注其分组过程中针对生物类似药特殊性的考量,以期为完善我国生物类似药相关管理政策提供参考。1德国生物类似药上市情况和参考价格组分类概述1.1德国生物类似药上市品种截至2022年5月27日,共有71个生物类似药在德国上市,涉及19个品种(表1)。首个上市的生物类似药为生长激素Genotropin®的生物类似药Omni-trope®,由山德士在2006年申请上市[3]。1.2参考价格组组别内部参考价格组分为3类:第一类为相同活性成分的药品,第二类为药理学及治疗学可比药品,第三类为具有相同适应证的复方制剂(表2)[4],已过专利保护期的原研药和生物类似药可被纳入参考价格组同组管理。德国已上市的19种生物类似药中,3种按第一类管理,6种按第二类管理,尚未有品种纳入第三类管理。此外,10种药品未进行分组,具体是生长激素、门冬胰岛素、甘精胰岛素、赖脯胰岛素、贝伐珠单抗、重组人促卵泡激素、雷珠单抗、利妥昔单抗、特立帕肽、曲妥珠单抗,可能与品种分组难度大、市场竞争不充分等多种因素有关。1.3参考价格组的作用1.3.1对生物药价格的影响参考价格组是德国管理生物类似药价格的主要措施之一。德国并不通过官方管理措施直接确定生物类似药价格,而是划分不同德国生物类似药参考价格组形成机制王欣悦,蒋蓉,何静雯,吴艺,邵蓉中国药科大学药品监管科学研究院,国家药品监督管理局药品监管创新与评价重点实验室,江苏南京211198[本文链接]http://doi.org/10.13688/j.cnki.chr.2022.220539【摘要】采用案例分析法分析德国已分组生物类似药的《决议》...