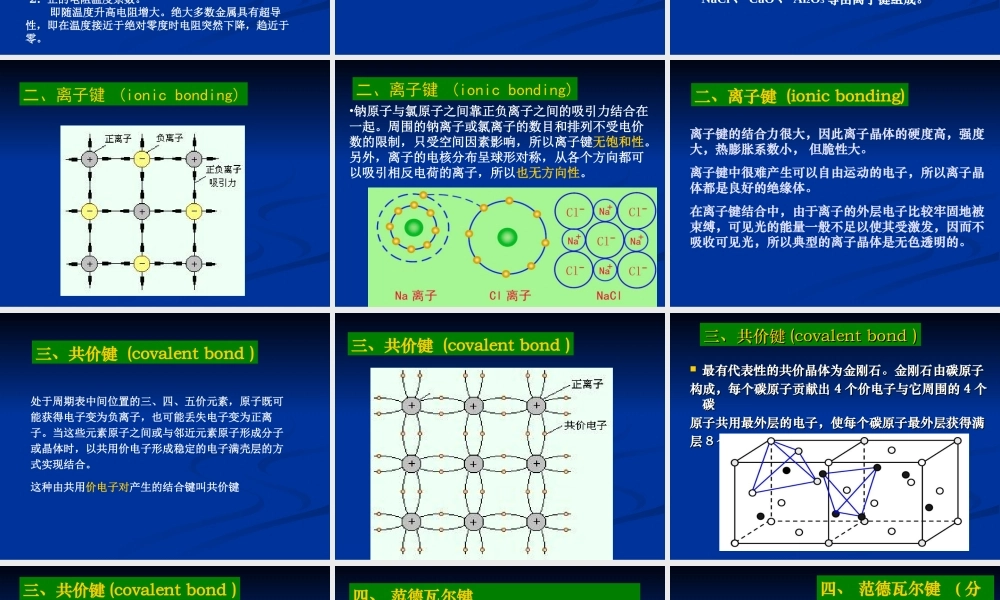
本章的重点:本章的重点:11、原子键合机制、原子键合机制22、三种常见的晶体结构及其基本性能。、三种常见的晶体结构及其基本性能。33、实际金属的晶体缺陷及其对性能的影响。、实际金属的晶体缺陷及其对性能的影响。44、结晶条件、结晶过程及细化晶粒的基本方法。、结晶条件、结晶过程及细化晶粒的基本方法。难点:结晶机理。晶面指数与晶向指数的确定。难点:结晶机理。晶面指数与晶向指数的确定。第二章材料的微观结构§2-1原子键合固态晶体材料是靠原子之间的相互作用力,即晶体的结合力或结合键结合在一起的。不同类型的原子之间产生不同性质的结合键。由电子运动使原子产生聚集的结合力为化学键。它是固体中的主要结合键。包括离子键、共价键和金属键三种。此外还有分子键,属于物理键,为聚集过程中不发生电子运动的的结合力。一、金属键(metallicbonding)周期表中Ⅰ、Ⅱ、Ⅲ族元素的原子在满壳层外有一个或几个价电子。原子很容易丢失其价电子而成为正离子。当金属原子处于聚集状态时,几乎所有的原子都将他们的价电子贡献出来,为整个原子集体共有,这些公有化的电子叫做自由电子,它们在正离子之间自由运动,形成所谓电子气。正离子在三维空间或电子气中呈高度对称的规则分布。正离子和电子气之间产生强烈的静电吸引力,使全部离子结合起来。这种结合力就叫做金属键。一、金属键(metallicbonding)在金属晶体中,价电子弥漫在整个体积内,所有的金属离子皆处于相同的环境之中,全部离子(或原子)均可被看成是具有一定体积的圆球,所以金属键无饱和性和方向性。一、金属键(metallicbonding)金属键结合的金属具有下列特性:1.良好的导电性和导热性。金属中有大量自由电子存在,当金属的两端存在电势差或外加电场时,电子可以定向地流动,使金属表现出优良的导电性。金属的导热性很好,一是由于自由电子的活动性很强,二是依靠金属离子振动的作用而导热。2.正的电阻温度系数。即随温度升高电阻增大。绝大多数金属具有超导性,即在温度接近于绝对零度时电阻突然下降,趋近于零。3.不透明并呈现特有的金属光泽。金属中的自由电子能吸收并随后辐射出大部分投射到表面的光能。4.良好的塑性变形能力,金属材料的强韧性好。金属键没有方向性,原子间也没有选择性,所以在受外力作用而发生原子位置的相对移动时,结合键不会遭到破坏。当周期表中相隔较远的正电性元素原子和负电性元素原子接触时,前者失去最外层价电子变成带正电荷的正离子,后者获得...