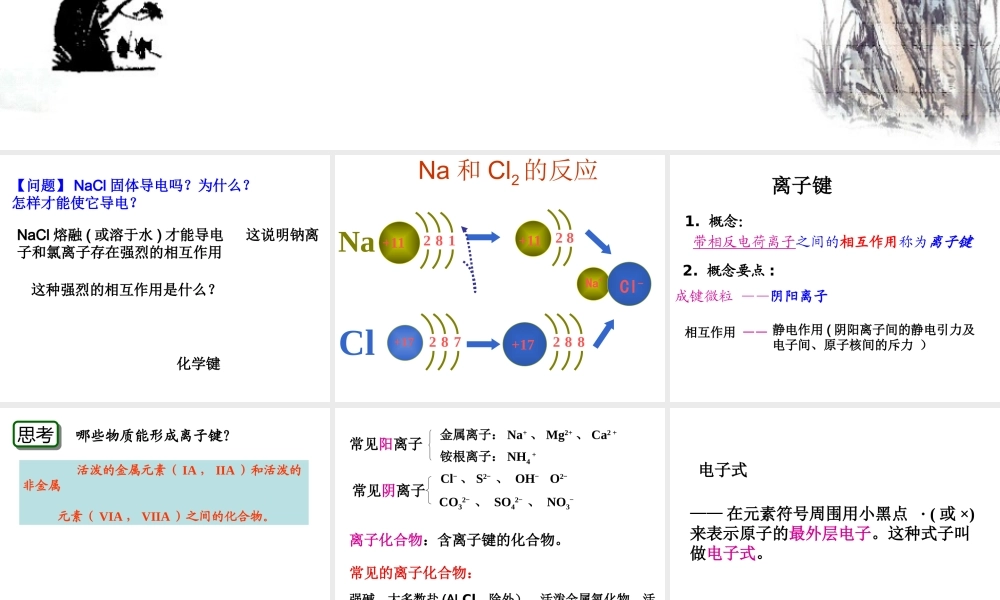
第一章《物质结构元素周期律》第三节化学键第一课时学科网【问题】NaCl固体导电吗?为什么?怎样才能使它导电?NaCl熔融(或溶于水)才能导电这说明钠离子和氯离子存在强烈的相互作用这种强烈的相互作用是什么?化学键Na+11812Cl+17872+1182+17882Na+Cl-Na和Cl2的反应1.概念:带相反电荷离子之间的相互作用称为离子键2.概念要点:成键微粒——阴阳离子相互作用——静电作用(阴阳离子间的静电引力及电子间、原子核间的斥力)离子键思考思考哪些物质能形成离子键?活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。学科网常见阳离子金属离子:Na+、Mg2+、Ca2+铵根离子:NH4+常见阴离子Cl-、S2-、OH-O2-CO32-、SO42-、NO3-离子化合物:含离子键的化合物。常见的离子化合物:强碱、大多数盐(AlCl3除外)、活泼金属氧化物、活泼金属氢化物——在元素符号周围用小黑点·(或×)来表示原子的最外层电子。这种式子叫做电子式。电子式表示原子电子式:NaMgClO‥Na××MgוCl•O•[练习]AlSiPSH‥‥∶‥每个方向不能超过两个电子,少于4个电子时以单电子分布,多于4时多出部分以电子对分布阳离子的电子式:对于阳离子来说,一般用阳离子符号(NH4+除外)表示,只要在元素符号右上角标出“n+”电荷字样。阳离子:Na+Mg2+Al3+HNHHH[]+学科网‥‥‥‥‥‥阴离子:[∶S∶]2-[∶Cl∶]-[∶O∶]2-[练习]:Ca2+Br–K+F–非金属阴离子电子式要做到“二标”即“[]”和“电荷数”阴离子的电子式不但要画出最外层电子数,一般均满足8电子(除H—)而且还应用括号[]括起来并在右上角标出“n—”字样离子化合物的电子式:由阴、阳离子的电子式组成,但相同离子不能合并,阴阳离子必须间隔着写。AB型A2B型AB2型Mg2O2-2....22:]Cl.[gMMgCl这样表示是错误的氮化钠的电子式NaNaNaN::::3-+++附:特殊物质的电子式氢化钠的电子式Na+H:-氯化铵的电子式-用电子式表示离子化合物的形成过程Mg2BrBrSKKBrMgBrS2-KK例:1.左边为原子的电子式、右边为离子化合物的电子式,中间用箭头连接,不能把“→”写成“=”。2.用箭头标明电子转移方向。书写要点:Cl][HClH练习1.下列用电子式表示化合物的形成过程正确的是:KOKO][K2K]MgFFMgF2[2[]Ba[]Cl[]Cl2BaClClABCD课堂练习(A)2.用电子式表示下列离子化合物的形成过程(1)Na2O(2)MgBr2(1)与上面A相似(2)