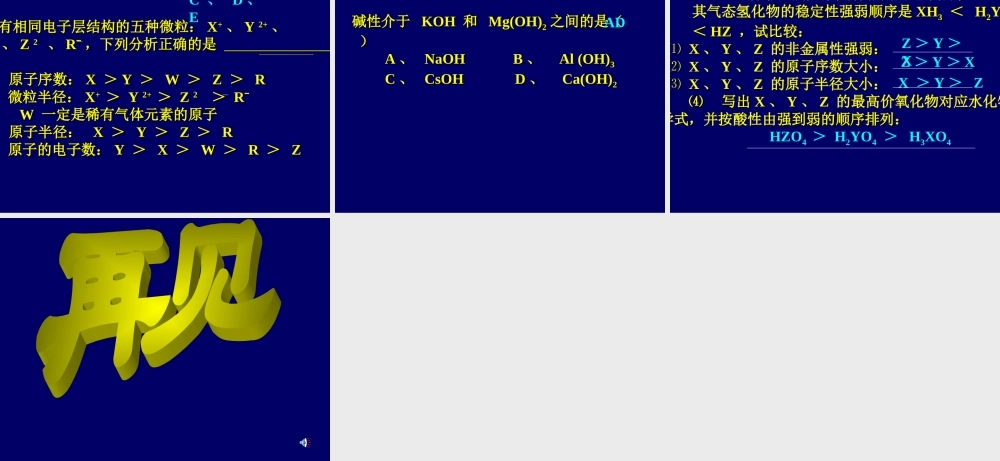
思考题:某元素的气态氢化物的符合通式RH4,且氢的质量分数为25%则R的最高价氧化物的化学式是()A.COB.CO2C.MgOD.SO2B练习:X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径,Z、Y、Z三种元素原子序数的大小顺序是A、X>Y>ZB、Y>X>ZC、Z>X>YD、Z>Y>X已知Xn+、Y(n+1)+、Zn-、R(n-1)-四种粒子都具有相同的电子层结构,这四种离子半径大小关系是A、Zn->R(n-1)->Xn+>Y(n+1)+B、Xn+>Y(n+1)+>Zn->R(n-1)-C、R(n-1)->Zn->Y(n+1)+>Xn+D、Xn+>Zn->Y(n+1)+>R(n-1)-奇偶规律一般情况,如果原子序数为奇(偶)数,则其在周期表中所处的族序数及最高正价也必为奇(偶)数练习若短周期的两元素可形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是A.1B.3C.5D.6短周期元素X和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,,则m和n的关系式不可能为(A)m-13=n(B)n+5=m(C)m+8=n(D)n-11=m三、元素周期表和元素周期律的应用元素在周期表中的位置,由元素原子的结构决定,而元素原子的结构又决定了元素的性质,即元素的性质是元素在元素周期表中的位置的外在反映。那么研究元素周期表和元素周期律有何意义呢?请您思考同一周期元素的金属性和非金属性变化有何规律?从左向右,元素的金属性逐渐减弱,非金属性逐渐增强。试用结构观点解释为什么有这样的变化规律:同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。请您思考同一主族元素的金属性和非金属性变化有何规律?自上而下,元素的金属性逐渐增强,非金属性逐渐减弱。试用结构观点解释为什么有这样的变化规律:同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。原子半径依次减小原子半径依次减小原子半径依次增大原子半径依次增大失电子能力依次增强失电子能力依次增强同一周期同一周期非金属性依次增强得电子能力依次增强得电子能力依次增强同一主族非金属性依次增强同一周期同一周期金属性依次增强同一主族金属性依次增强预测元素的性质(由递变规律推测)铊是超导材料的组成元素之一,铊在周期表中位于第6周期,是81号元素,元素符号是T1,以下对铊的性质的推断不正确的是A.铊是易导电的银白色金属B.能生成+3价离子化...