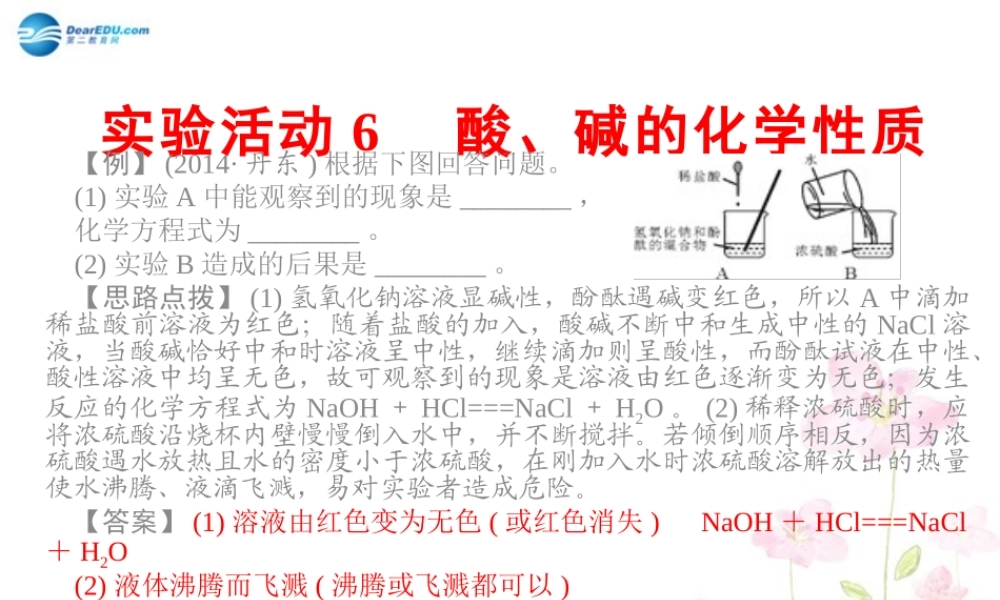
实验活动6酸、碱的化学性质【例】(2014·丹东)根据下图回答问题。(1)实验A中能观察到的现象是________,化学方程式为________。(2)实验B造成的后果是________。【思路点拨】(1)氢氧化钠溶液显碱性,酚酞遇碱变红色,所以A中滴加稀盐酸前溶液为红色;随着盐酸的加入,酸碱不断中和生成中性的NaCl溶液,当酸碱恰好中和时溶液呈中性,继续滴加则呈酸性,而酚酞试液在中性、酸性溶液中均呈无色,故可观察到的现象是溶液由红色逐渐变为无色;发生反应的化学方程式为NaOH+HCl===NaCl+H2O。(2)稀释浓硫酸时,应将浓硫酸沿烧杯内壁慢慢倒入水中,并不断搅拌。若倾倒顺序相反,因为浓硫酸遇水放热且水的密度小于浓硫酸,在刚加入水时浓硫酸溶解放出的热量使水沸腾、液滴飞溅,易对实验者造成危险。【答案】(1)溶液由红色变为无色(或红色消失)NaOH+HCl===NaCl+H2O(2)液体沸腾而飞溅(沸腾或飞溅都可以)实验活动6酸、碱的化学性质举一反三(2014·内江)将稀硫酸滴入一定量的氧化铜粉末中,使固体刚好溶解后滴入适量的氢氧化钠溶液至反应完全。请依次写出相关的化学反应方程式:(1)__CuO+H2SO4===CuSO4+H2O__,(2)__CuSO4+2NaOH===Cu(OH)2↓+Na2SO4__。【实验目的】1.学会借助酸碱指示剂分析酸碱中和反应。2.加深对酸和碱的主要化学性质的认识。3.通过实验解释生活中的一些现象,将所学知识运用于生活中。【实验用品】试管、药匙、蒸发皿、酒精灯、玻璃棒、稀盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。【实验步骤】一、酸、碱与指示剂的作用:现象稀盐酸稀硫酸氢氧化钠溶液氢氧化钙溶液分别加入1~2滴紫色石蕊溶液红色红色蓝色蓝色分别加入1~2滴无色酚酞溶液无色无色红色红色实验活动6酸、碱的化学性质二、生锈的铁钉与稀盐酸的反应:将一个生锈的铁钉放入试管中,然后加入稀盐酸,可以看到__铁锈逐渐消失,溶液由无色变为黄色__;反应的化学方程式为__Fe2O3+6HCl===2FeCl3+3H2O__;过一段时间后,可以看到__有气泡产生__;反应的化学方程式为__Fe+2HCl===FeCl2+H2↑__。三、碱的化学性质:1.在试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到__产生蓝色絮状沉淀__;反应的化学方程式为__2NaOH+CuSO4===Na2SO4+Cu(OH)2↓__;然后加入足量的稀盐酸,观察到__沉淀消失,溶液变为蓝色__;反应的化学方程式为__Cu(OH)2+2HCl===CuCl2+2H2O__。2.向1支试管中加入约1mL的氢...