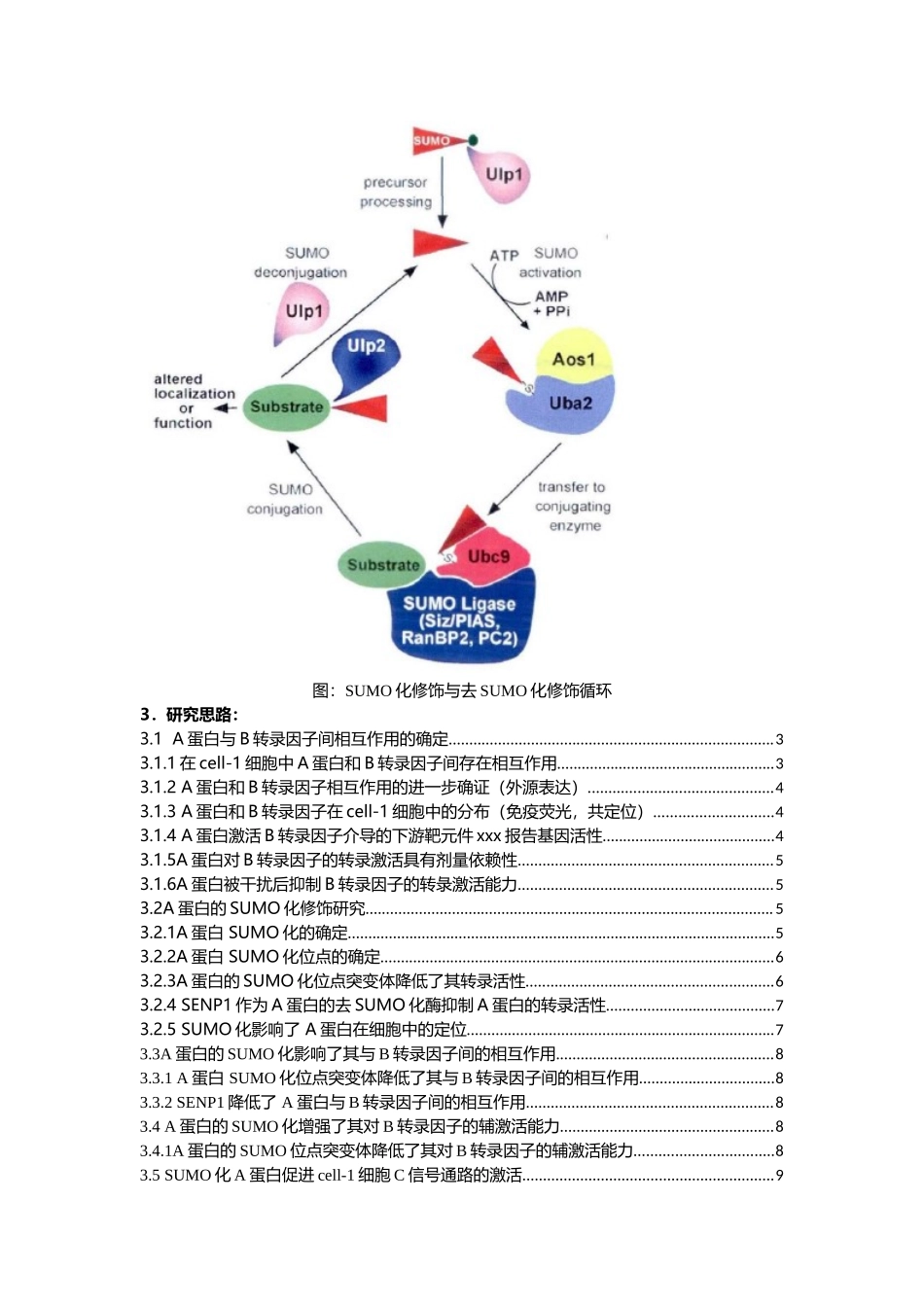
分子机制研究套路(一)蛋白翻译后修饰-SUMO化课题:SUMO化A蛋白对B转录因子介导的C信号通路的调控1.概念介绍:蛋白质是生命活动中各种功能的执行者,其功能正常与否决定着生命活动能否有序、高效的进行,而其中蛋白质翻译后修饰起着至关重要的作用。蛋白质翻译之后,翻译后修饰改变了蛋白质中氨基酸残基上的生物化学官能团,进而改变其化学性质或结构,使得蛋白质具有更为复杂的结构,更为完善的功能,更为精细的调节。蛋白质的翻译后修饰过程极其复杂,已知的翻译后修饰种类有20多种。但其中较为常见的主要是泛素化、磷酸化、乙酷化、SUMO化、甲基化以及糖基化。类泛素(SmallUbiquitin-likeModifier,SUMO)化修饰作为一种重要的翻译后修饰方式对蛋白质的功能有广泛的调节作用,主要包括调节蛋白质的细胞定位,蛋白质之间的相互作用以及蛋白质的活性等方面。据研究报道,在对SUMO化修饰的目的蛋白进行分析之后,SUMO化修饰主要发生在保守序列ΨKXE中的赖氨酸位点K上。Ψ表示脂肪族氨基酸,更倾向于亮氨酸L、异亮氨酸I、缴氨酸V。2.示意图:SUMO化修饰过程与泛素化类似,包含E1活化酶,E2结合酶和E3连接酶三个酶的级联反应。SUMO在最初合成时是一种前体形式,像泛素一样,需要蛋白剪切酶进行活化加工,形成能够结合到底物赖氨酸上的异构肽键。在啤酒酵母中,这一过程的剪切酶为Ulpl。C端成熟的SUMO首先由SUMO活化酶E1所活化,E1是异二聚体蛋白复合物,由Uba2和Aosl所组成。活化过程需要ATP的参与,通过SUMO腺苷中间体将SUMO与Uba2上的半胱氨酸残基通过硫酯键连接起来。活化后的SUMO接下来被转移到SUMO结合酶E2Ubc9的半胱氨酸残基上,SUMO连接酶E3结合并催化SUMO连接到底物蛋白上。不同的SUMO化修饰底物有不同的SUMO连接酶E3,而Ubc9则能够与各种底物蛋白相结合。去SUMO化修饰反应是由具有异构酶活性的Ulpl和Ulp2蛋白所执行的。SUMO连接酶E3主要有三大家族:PIAS、RanBP2和PC2,他们都能与Ubc9相互作用促进SUMO化修饰。图:SUMO化修饰与去SUMO化修饰循环3.研究思路:3.1A蛋白与B转录因子间相互作用的确定...............................................................................33.1.1在cell-1细胞中A蛋白和B转录因子间存在相互作用.....................................................33.1.2A蛋白和B转录因子相互作用的进一步确证(外源表达).............................................43.1.3A蛋白和B转录因子在cell-1细胞中的分布(免疫荧光,共定位...