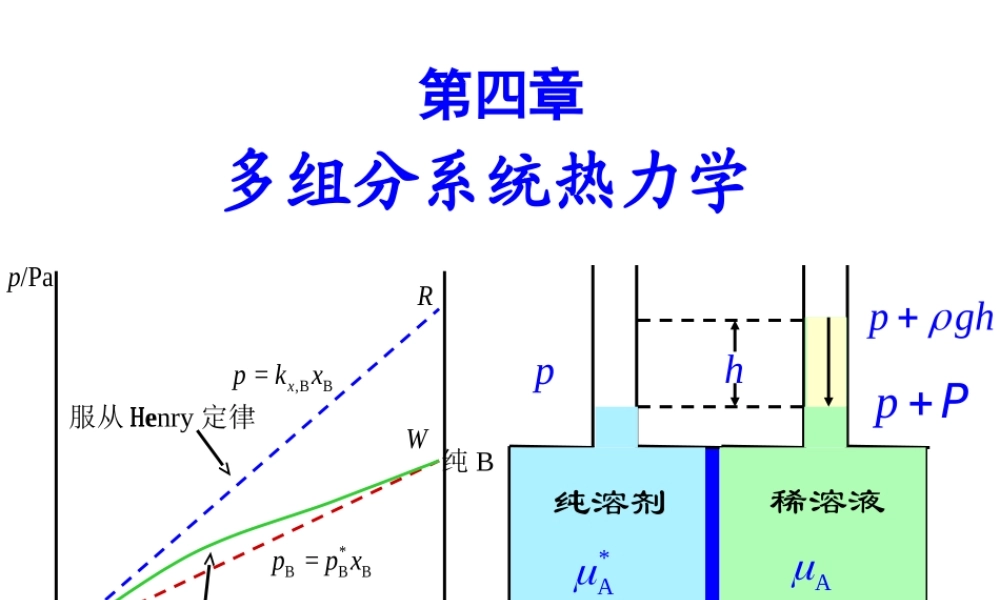
第四章多组分系统热力学/PapRW,BB=xpkx纯B实际曲线服从Henry定律ABBxAx*BBB=ppx纯溶剂*A稀溶液AhppPpgh半透膜第四章多组分系统热力学§4.1偏摩尔量§4.2化学势§4.3气体组分的化学势§4.4逸度及逸度因子§4.5拉乌尔定律和亨利定律§4.6理想液态混合物§4.7理想稀溶液§4.8活度及活度因子§4.9稀溶液的依数性本章总结前几章介绍了简单系统发生pVT变化、相变化、和化学变化时W、Q、S、U、H、A、G的计算。所谓简单系统是指由纯物质形成的相及组成不变的相组成的平衡系统。但常见系统多数为多组分系统和相组成发生变化的系统。此即本章以下所研究的内容。溶液(Solution)多组分单相系统(Multi-ComponentHomogeneousSystem)混合物(Mixture)将组分区分为溶剂和溶质,且对二者选择不同的标准态,使用不同的经验定律。各组分均可选用相同的标准态,使用相同的经验定律。气态混合物、液态混合物和固态混合物。根据物态可分为气态溶液、固态溶液和液态溶液;根据溶质的导电性可分为电解质溶液和非电解质溶液。本章主要讨论液态混合物、及液态非电解质溶液。根据规律性划分:溶液(Solution)混合物(Mixture)理想稀溶液真实溶液理想混合物真实混合物在全部浓度范围内,符合简单规律在一定浓度区间,符合相应的简单规律混合物可有气态混合物、液态混合物及固态混合物,本章中,混合物指液态混合物。溶液也可有气态、液态及固态溶液,本章中,溶液指液态溶液。混合物可分为理想混合物及真实混合物;溶液可分为理想稀溶液及真实溶液。理想混合物在全部浓度范围内及理想稀溶液在小范围内均有简单的规律性。按溶质的导电性能,溶液可分成电解质溶液和非电解质溶液,本章只讨论非电解质溶液。§4.1偏摩尔量•问题的提出•偏摩尔量•偏摩尔量的测定法举例•偏摩尔量与摩尔量的差别•右布斯-杜亥姆方程•偏摩尔量之间的函数关系一、问题的提出Vm*水=18.09cm3·mol–1V*=nVm*水=36.18cm3=水混合:1molH2O(l)+1molH2O(l)36.18cm318.09cm318.09cm3Vm*乙醇=58.35cm3·mol-1V*=nVm*乙醇=116.70cm358.35cm358.35cm3116.70cm3乙醇混合:1molC2H5OH(l)+1molC2H5OH(l)=偏摩尔量(partialmolarquantity)20℃、105Pa下,乙醇水混合物体积与各物质的量的关系n(C2H5OH)/moln(H2O)/mol混合前两液体总体积ΣnBVm(B)/10-6m3混合后溶液体积V/10-6m3混合前后体积差ΔV/10-6m30.040.140.280.370.480.610.780.960.860.720.630.520.390.2219.823.729.333.037.342.74...