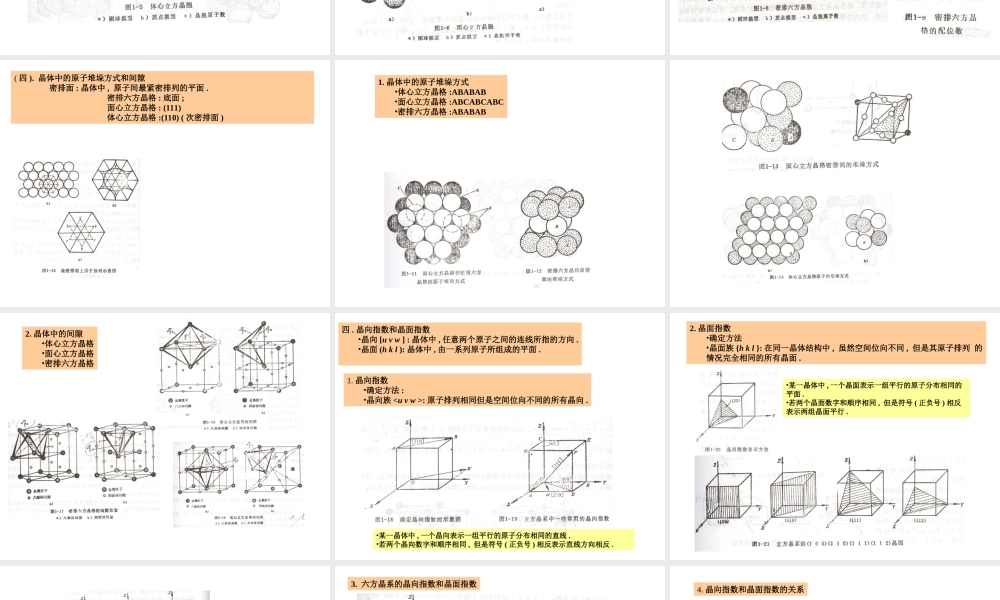
思考:1.什么是金属?2.金属原子是如何结合到一起的?3.为什么不同原子的金属性能不同?4.为什么同种原子的金属有时性能也不同?5.金属的内部组织结构是什么样子?第一章金属的晶体结构1.1金属–金属:具有正的电阻温度系数的物质.–非金属:具有负的电阻温度系数的物质.壹.金属原子的结构特点:孤立的自由原子=带正电的原子核+带负电的核外电子核外电子=内层电子+外层电子价电子=最外层的电子•金属原子的结构特点:外层4个价电子;正电性元素.•非金属原子的结构特点:外层4-7个价电子;负电性元素.•过渡族金属原子的结构特点:化合价可变.二.金属键•离子键:氯化钠•共价键:金刚石•金属键:电子云三.结合力与结合能原子间结合力=原子间吸引力+排斥力do:平衡点,吸引力=排斥力.结合力=0.dc:最大结合力=理论抗拉强度.原子间结合能=原子间吸引能+排斥能do:结合能最低,原子的势能最低、最稳定。EAB:原子间结合能当大量原子结合成固体时,为使固态金属具有最低的能量,以保持其稳定状态,大量原子间必须保持一定的平衡距离,是固态金属的原子趋于规则排列的重要原因。1.2金属的晶体结构•晶体:在三维空间作有规律的周期性排列的物质.•非晶体:内部原子是散乱分布的。•在一定条件下,晶体和非晶体可以互相转换。一.晶体的特性•有一定熔点.•各向异性.二.晶格与晶胞•阵点(结点):原子(离子、分子、原子群、分子群)抽象的几何点。•空间点阵(晶格):用直线将阵点连接起来,构成一个描述晶体中原子排列规律的三维空间格架。•晶胞:晶格中能够完全反映晶格特征的最小的几何单元。•晶格常数(点阵常数):晶胞的棱边长度,X、Y、Z轴为a,b,c.•轴夹角:晶胞的棱边夹角,Y-Z、Z-X、X-Y为、、。三.三种典型的金属晶体结构(一)体心立方晶格---BCC(bodycenteredcubic)•结构特点•原子半径•原子数:1+1/8x8=2•配位数:8(与任一原子等距离、最近邻的原子总数)•致密度:0.68(K=nV1/V)(二)面心立方晶格---FCC(facecenteredcubic)•结构特点:•原子半径•原子数:1/8x8+1/2x6=4•配位数:3x4=12•致密度:0.74(三)密排六方晶格---HCP(hexagonalclose-packed)•结构特点•原子半径:a/2•原子数:1/6x12+½x2+3=6•配位数:6+2x3=12•致密度:0.74•c/a=1.633(四).晶体中的原子堆垛方式和间隙密排面:晶体中,原子间最紧密排列的平面.密排六方晶格:底面;面心立方晶格:(111)体心立方晶格:(110)(次密排面)1.晶体中的原子堆垛方式•体心立方晶格:ABABAB•面心立方晶格:ABCABCA...