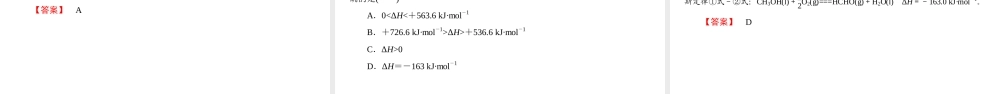知识点一知识点二学业分层测评第三节化学反应热的计算1.从能量守恒的角度理解并掌握盖斯定律。2.能正确运用盖斯定律解决具体问题。(重点)3.掌握化学反应热的有关计算。盖斯定律[基础·初探]教材整理1.内容不论化学反应是一步完成或分几步完成,其反应热。2.能量守恒定律相同从S→L,ΔH1<0,体系;从L→S,ΔH2>0,体系;结论:(1)ΔH1+ΔH2=0;(2)反应的热效应只与始态、终态有关,与无关。放热吸热途经3.意义利用盖斯定律,可以间接计算难以直接测定的反应热。(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多。()(2)化学反应的反应热与化学反应的始态有关,与终态无关。()(3)利用盖斯定律,可计算某些反应的反应热。()(4)任何化学反应的反应热都可以直接测定。()【答案】(1)×(2)×(3)√(4)×[合作·探究]盖斯定律的应用[探究背景]已知下述两个反应的ΔH可以直接测得:(1)C(s)+O2(g)===CO2(g)ΔH1=-393.5kJ·mol-1(2)CO(g)+12O2(g)===CO2(g)ΔH2=-283kJ·mol-1[探究问题]1.转化关系中表示C(s)→CO2(g)有几种转化方式?【提示】有两种。C(s)→CO(g)→CO2;C(s)→CO2(g)。2.上述转化关系中ΔH1、ΔH2、ΔH3有什么关系?【提示】ΔH1=ΔH2+ΔH3或ΔH3=ΔH1-ΔH2。3.如何由已知两个热化学方程式快速求得C(s)→CO(g)的热化学方程式?【提示】热化学方程式(1)-(2)得:C(s)+12O2(g)===CO(g)ΔH=-110.5kJ·mol-1[核心·突破]1.利用盖斯定律书写热化学方程式的一般步骤2.利用盖斯定律计算反应热的方法(1)加和法:将所给热化学方程式适当加减得到所求热化学方程式,从而得到反应热。(2)虚拟途径法①方法:先根据题意虚拟转化过程,然后根据盖斯定律列式求解,即可求得待求的反应热。②举例:若反应物A变为生成物D,可以有两个途径,如图:则有:ΔH=ΔH1+ΔH2+ΔH3。[题组·冲关]题组1利用盖斯定律书写热化学方程式1.已知①C(s)+12O2(g)===CO(g);②2H2(g)+O2(g)===2H2O(g)。经过哪个计算过程可得到C(s)+H2O(g)===CO(g)+H2(g)()A.①-②B.①+②C.①-12②D.①+12②【答案】C2.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:①N2(g)+2O2(g)===N2O4(g)ΔH=+8.7kJ·mol-1②N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0kJ·mol-1下列表示肼与N2O4反应的热化学方程式,正确的是()A.2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)ΔH=-542.7kJ·mol-1B...