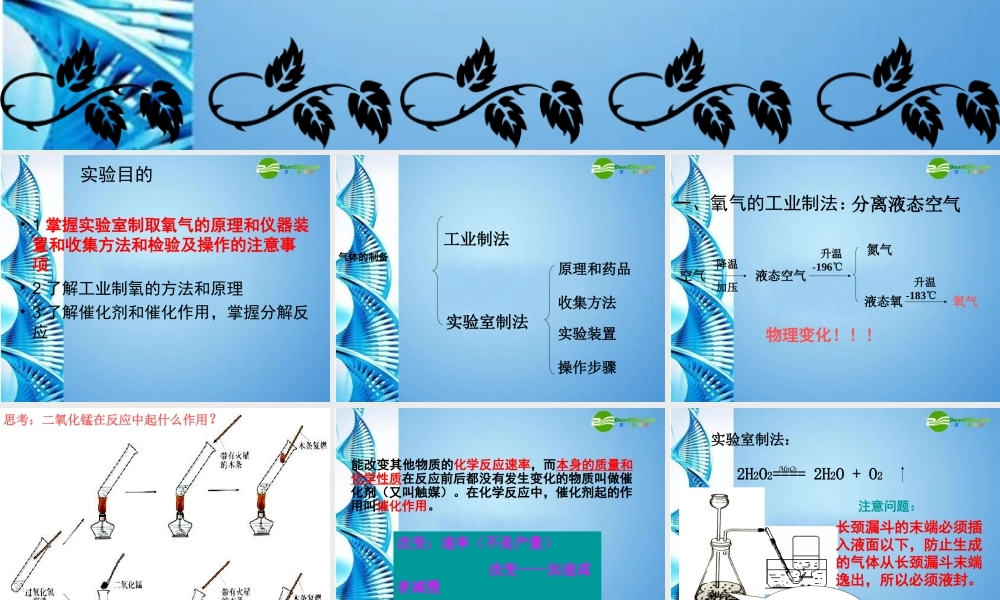
实验目的•1掌握实验室制取氧气的原理和仪器装置和收集方法和检验及操作的注意事项•2了解工业制氧的方法和原理•3了解催化剂和催化作用,掌握分解反应气体的制备实验室制法工业制法原理和药品收集方法实验装置操作步骤一、氧气的工业制法:空气氮气液态空气降温加压升温-196℃液态氧升温-183℃氧气物理变化!!!分离液态空气思考:二氧化锰在反应中起什么作用?能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒)。在化学反应中,催化剂起的作用叫催化作用。改变:速率(不是产量)改变——加速或者减慢不变:化学性质、质量实验室制法:2H2O2====2H2O+O2MnO2注意问题:如何检查此装置的气密性?长颈漏斗的末端必须插入液面以下,防止生成的气体从长颈漏斗末端逸出,所以必须液封。与上一装置相比此装置的优点?3.实验装置1:2H2O2=2H2O+O2↑MnO2*使用长颈漏斗要注意液封,即液面要高于长颈漏斗末端固液(液液)反应制气体发生装置四、操作步骤1.检查装置气密性。•方法一:向长颈漏斗中加水,使末端在液面以下,双手握住锥形瓶,如导管末端有气泡冒出,说明装置气密性良好.•方法二:用弹簧夹夹紧橡皮管,向长颈漏斗中加水,如在长颈漏斗末端留有一段水柱,说明装置气密性良好.2、先向锥形瓶加入少量固体二氧化锰,塞紧瓶塞再由长颈漏斗加入过氧化氢溶液。用排水法或向上排空气法3、收集氧气:氧气不易溶于水、密度比空气大。选用什么方法收集?4、验满与检验:排水法收集时,从集气瓶口逸出大气泡时已集满。若用向上排空气法收集时,用带火星的木条放在集气瓶口处,木条复燃,证明已满。5、撤离,将用剩的药品到入废液缸,洗涤仪器。2.用过氧化氢和二氧化锰混合物制取氧气的实验步骤可简称:查;装;收;拆;洗利用其它含氧元素的物质,如高锰酸钾(KMnO4)、氯酸钾(KClO3)等也可以制氧气练习:下列有关催化剂的叙述正确的是()A、在化学反应里能加快其他物质的化学反应速率,而本身的质量和性质在反应前后没有改变的物质。B、二氧化锰是催化剂。C、在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有改变的物质。D、要使过氧化氢溶液分解出氧气,必须要加入二氧化锰,否则就不能发生反应。C反应物都是固体,反应需要加热反应物是固体和液体的混合物,反应不需要加热固液不加热型固固加热型对实验室制取气体的小结:返回•练习、现有下列A、B、C、D、E五种...