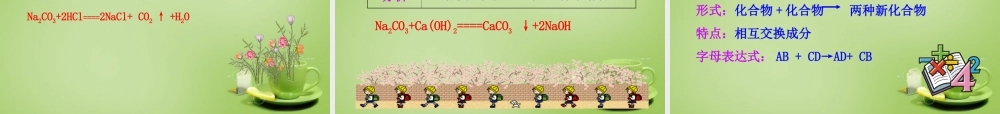
第十一单元盐化肥课题1生活中常见的盐1.通过资料收集和实验探究,认识生活中常见的盐的种类和用途。2.初步学会粗盐提纯和鉴定碳酸根离子的方法。3.能判断复分解反应的类型及发生条件。日常生活中所说的盐,通常指食盐(NaCl),而化学中的盐是指含有金属离子和酸根离子的一类化合物。如碳酸钠、碳酸氢钠、碳酸钙、硫酸铜等都属于盐。1.重要的调味品2.人体正常生理活动中不可缺少的物质3.日常生活中用来腌制食品4.工业的原料:氯碱工业一、氯化钠海南省东方盐场晒盐一景世界上最大的盐矿储地是柴达木盆地,储量约为900多亿吨。用海水晒盐或用盐井水、盐湖水煮盐可以使水蒸发,使氯化钠溶液达到饱和,继续蒸发,有氯化钠晶体析出。这样制得的盐含有较多杂质,叫做粗盐。粗盐经溶解、沉淀、过滤、蒸发、结晶,可制得精盐。用溶解度知识解释海水晒盐的原因?想一想温度不变,氯化钠的溶解度不变,海水蒸发后,溶剂的量减少,食盐晶体析出。【温故知新】粗盐初步提纯:(除去不溶性杂质)(1)步骤:①溶解:玻璃棒作用:搅拌,加速溶解②过滤:“一贴、二低、三靠”玻璃棒作用:引流,防止液体飞溅③蒸发:a.玻璃棒作用:搅拌,防止液体温度局部过高而飞溅b.当蒸发皿中出现较多固体时,停止加热,利用余热使滤液蒸干(2)仪器烧杯、漏斗、蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)④计算产率:粗盐产率=×100%精盐质量溶解粗盐质量在此过程中玻璃棒的作用:转移固体二、碳酸钠、碳酸氢钠和碳酸钙1.碳酸钠(Na2CO3)(1)俗名:纯碱、苏打。(2)纯碱不是碱,是盐(水溶液显碱性)。(3)用途:玻璃、造纸、纺织和洗涤剂的生产等。2.碳酸氢钠(NaHCO3)(1)俗名:小苏打。(2)用途:焙制糕点、治疗胃酸过多。3.碳酸钙(CaCO3)(1)大理石、石灰石的主要成分。(2)用途:建筑材料、补钙剂。回顾二氧化碳的实验室制法CaCO3+2HCl====CaCl2+H2CO3CaCO3+2HCl====CaCl2+CO2↑+H2OCO2↑+H2O碳酸钠+盐酸碳酸氢钠+盐酸现象分析出现大量气泡,澄清石灰水变浑浊迅速出现大量气泡,澄清石灰水变浑浊有二氧化碳生成有二氧化碳生成与酸反应:Na2CO3+2HCl====2NaCl+H2CO3Na2CO3+2HCl====2NaCl+CO2↑+H2OCO2↑+H2O碳酸钠溶液+澄清石灰水现象分析出现白色沉淀二者发生反应,生成一种难溶物与碱反应:Na2CO3+Ca(OH)2====CaCO3↓+2NaOH复分解反应定义:两种化合物互相交换成分,生成另外两种化合物的反应。形式:化合物+化合物两种新化合物特点:相互交换成分字母表达式...