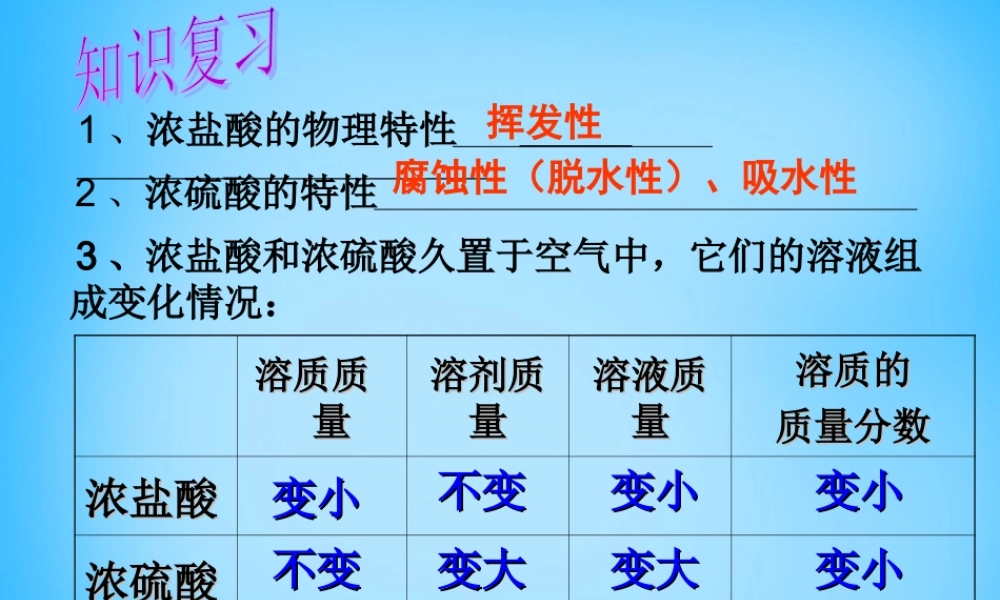
溶质质溶质质量量溶剂质溶剂质量量溶液质溶液质量量溶质的溶质的质量分数质量分数浓盐酸浓盐酸浓硫酸浓硫酸变小变小不变不变不变不变变大变大变小变小变小变小变小变小变大变大1、浓盐酸的物理特性挥发性2、浓硫酸的特性腐蚀性(脱水性)、吸水性3、浓盐酸和浓硫酸久置于空气中,它们的溶液组成变化情况:4、在酸溶液中存在的相同离子是H+第十单元酸和碱第十单元酸和碱课题课题11常见的酸和碱常见的酸和碱第三课时稀盐酸、稀硫酸的第三课时稀盐酸、稀硫酸的化学性质化学性质加紫色石蕊溶液加无色酚酞溶液稀盐酸稀硫酸结论:酸能与指示剂反应紫色石蕊溶液变红色紫色石蕊溶液变红色无色酚酞溶液不变色无色酚酞溶液不变色探究:稀盐酸和稀硫酸的化学性质1.稀盐酸、稀硫酸与指示剂作用①①酸溶液能使紫色石蕊试液变成红色,酸溶液能使紫色石蕊试液变成红色,②②酸溶液不能使无色酚酞试液变色。酸溶液不能使无色酚酞试液变色。该性质有何用途?该性质有何用途?利用酸溶液与指示剂作用颜色的变化,可以检验酸类物质的存在。2、酸与金属反应与稀盐酸反应与稀硫酸反应镁现象化学方程式铝现象化学方程式铁现象化学方程式锌现象化学方程式剧烈反应,产生大量气泡剧烈反应,产生大量气泡Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+H2SO4=FeSO4+H2↑Mg+H2SO4=MgSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Fe+2HCl=FeCl2+H2↑2Al+6HCl=2AlCl3+3H2↑2Al+3H2SO4=Al2(SO4)3+3H2↑反应较剧烈,产生较多气泡反应较剧烈,产生较多气泡反应比较慢,产生少量气泡反应比较慢,产生少量气泡反应较剧烈,产生较多气泡反应较剧烈,产生较多气泡酸能与多种活泼金属反应,生成氢气。同时生成一种叫做盐的化合物。酸酸++金属→盐金属→盐++氢气(置换反氢气(置换反应)应)盐:由金属离子和酸根离子构成的化合物。盐:由金属离子和酸根离子构成的化合物。注意:NH4Cl、NH4NO3等属于铵盐,不含金属元素。⒊酸溶液能与金属氧化物反应•实验:实验:•①①在试管中放入生锈铁钉,再加入在试管中放入生锈铁钉,再加入1mL1mL稀稀盐酸(或硫酸)盐酸(或硫酸)•②②在试管中放入少量在试管中放入少量CuOCuO粉末,再加入粉末,再加入11mLmL稀硫酸(或稀盐酸),加热。稀硫酸(或稀盐酸),加热。现象化学方程式铁锈+盐酸铁锈+硫酸氧化铜+盐酸氧化铜+硫酸Fe2O3+3H2SO4=Fe2(SO4)3+3H2O铁锈逐渐消失、溶液由无色变为黄色铁锈逐渐消失、溶液由无色变为黄色Fe2O3+6HCl=2FeCl3+3H2O黑色粉末逐渐消失、溶液...