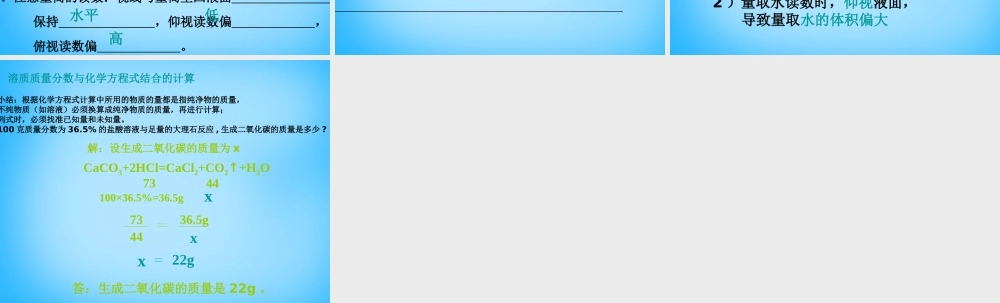
一定溶质质量分数的溶液的配制一、回顾已知,引入新课溶质的质量分数=×l00%=×l00%溶液质量=溶质质量+溶剂质量=溶液的密度×溶液体积溶质质量=×溶剂质量=-溶质质量溶液质量溶质质量溶质质量+溶剂质量溶质的质量分数溶液质量溶质质量溶液质量0g质量分数为6%的氯化钠溶液。制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠水g。托盘天平称量所需的氯化钠,倒人烧杯中。量筒量取所需的水(把水的密度看成1g/cm3),倒入盛有氯化钠的烧杯里玻璃棒搅拌,使氯化钠溶解。二、自主学习一)溶液的配制50×6%=350-3=47验二配制质量分数为3%的氯化钠溶液。已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),制50g质量分数为3%的氯化钠溶液。计算:配制50g质量分数为3%的氯化钠溶液所需6%氯化钠溶液和水的质量分别为6%氯化钠溶液g(体积mL);水g。量取:用量筒量取所需的氯化钠溶液和水,倒人烧杯中。混匀:用玻璃棒搅拌,使溶液混合均匀。把配制好的上述两种溶液分别装入中,盖好瓶塞并贴上标签标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。252425试剂瓶.使用天平时,应注意左右。.因为水为液体,且其密度为1g/cm3,所以测定水的体积比质量方便。.选择量筒的标准:量筒大小与所取液体体积最接近,若大,则残留在量筒壁上液体过多,且读数误差大,若小,则量取次数多,误差大。.注意量筒的读数:视线与量筒里凹液面保持,仰视读数偏,俯视读数偏。注意事项:物砝最低水平低高1.配制一定量质量分数一定的溶液的基本步骤:①②③④仪器:、、、、、计算称量/量取溶解装瓶天平量筒烧杯玻璃棒药匙细口瓶讨论哪些因素可造成配得的溶液溶质质量分数偏低或偏高?偏低:1)称量固体时物体和砝码的位置放反,导致称量固体质量偏小偏高:量取水读数时,俯视液面,导致量取水的体积偏小2)量取水读数时,仰视液面,导致量取水的体积偏大小结:根据化学方程式计算中所用的物质的量都是指纯净物的质量,不纯物质(如溶液)必须换算成纯净物质的质量,再进行计算;列式时,必须找准已知量和未知量。100克质量分数为36.5%的盐酸溶液与足量的大理石反应,生成二氧化碳的质量是多少?溶质质量分数与化学方程式结合的计算解:设生成二氧化碳的质量为xCaCO3+2HCl=CaCl2+CO2↑+H2O7344100×36.5%=36.5gxx447336.5g22gx答:生成二氧化碳的质量是22g。