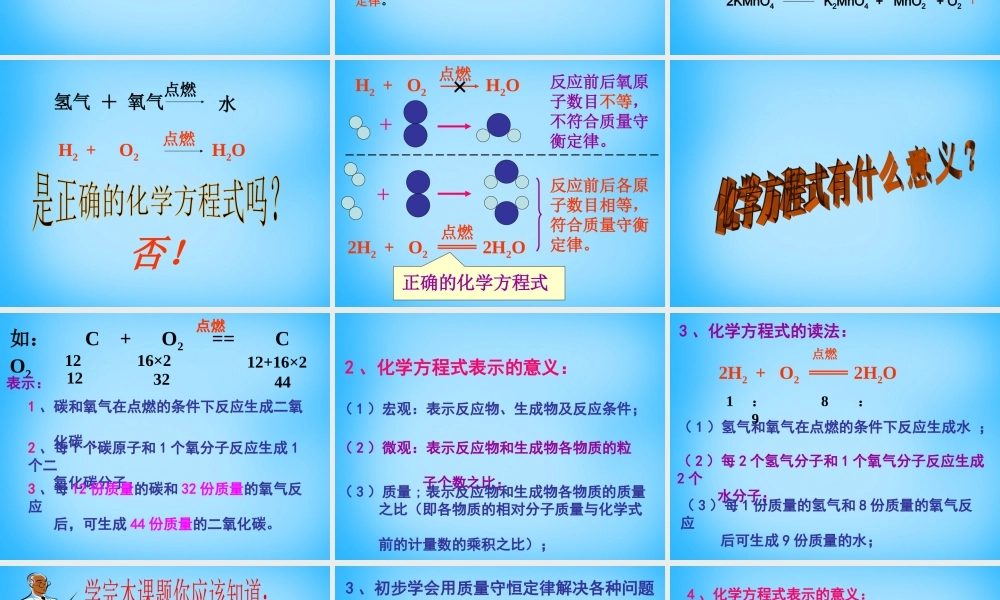
课题1第二课时参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。1、质量守恒定律:反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有改变。2、化学反应前后总质量守恒的原因原子数目原子质量原子种类微观元素质量元素种类不变不变物质的种类分子的种类改变宏观可能改变分子数目物质的总质量元素的化合价4.关于质量守恒定律应注意的问题:2、质量守恒定律讨论的对象是化学反应的质量问题,与物理变化无关。即质量守恒定律不能用于讨论物理变化。1、若选择有气体参加或有气体生成的化学反应来证明质量守恒定律,则反应一定要在密闭容器内进行。化学方程式思考:怎样用一个式子来表示化学反应呢?如:木炭在氧气中燃烧生成二氧化碳点燃碳+氧气二氧化碳该式子确实能表示反应物、生成物及反应条件;但书写不方便、国际上也不通用且不能体现质量守恒定律。化学方程式点燃碳+氧气二氧化碳文字表达式:化学方程式:C+O2CO2点燃如:3Fe+2O2Fe3O4点燃2KMnO4K2MnO4+MnO2+O2一、化学方程式:用化学式来表示化学反应的式子氢气+氧气点燃水H2+O2H2O点燃否!H2+O2H2O点燃+反应前后氧原子数目不等,不符合质量守衡定律。+×2H2+O22H2O点燃反应前后各原子数目相等,符合质量守衡定律。正确的化学方程式如:C+O2==CO2点燃表示:1、碳和氧气在点燃的条件下反应生成二氧化碳;2、每1个碳原子和1个氧分子反应生成1个二氧化碳分子;3、每12份质量的碳和32份质量的氧气反应后,可生成44份质量的二氧化碳。1216×212+16×23244122、化学方程式表示的意义:(1)宏观:表示反应物、生成物及反应条件;(2)微观:表示反应物和生成物各物质的粒子个数之比;(3)质量;表示反应物和生成物各物质的质量之比(即各物质的相对分子质量与化学式前的计量数的乘积之比);3、化学方程式的读法:(1)氢气和氧气在点燃的条件下反应生成水;(2)每2个氢气分子和1个氧气分子反应生成2个水分子;(3)每1份质量的氢气和8份质量的氧气反应后可生成9份质量的水;2H2+O22H2O点燃1:8:91、质量守恒定律是指参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。2、化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合而生成其他物质(生成物)的过程。因此,在化学反应前后原子的种类数目质量不变。3、初步学会用质量守恒定律解决各种问题①解释某种状态的物质反应前后质量改变的现象②驳斥诸如“水变燃油”等谬论③推导物质...