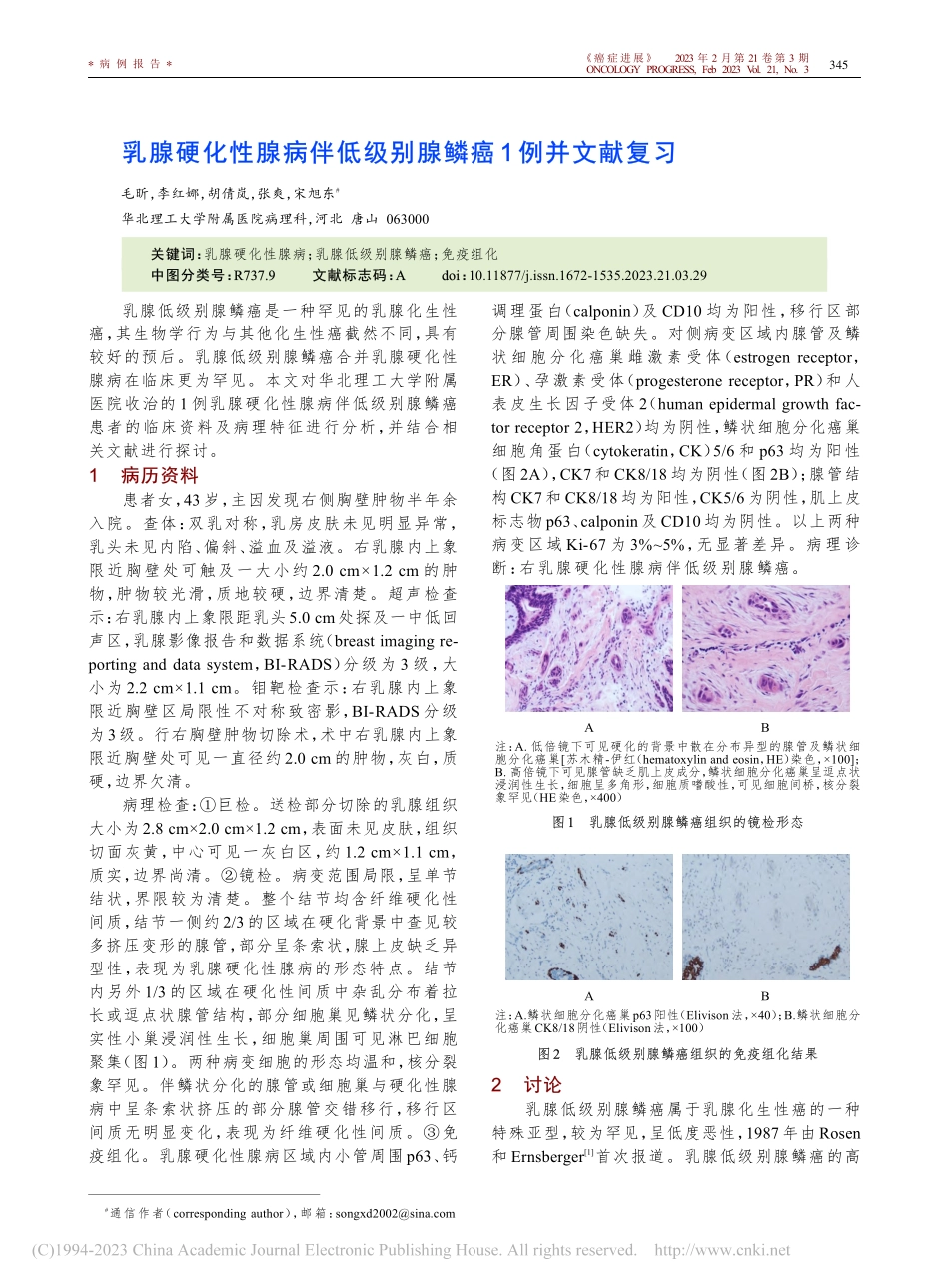
《癌症进展》2023年2月第21卷第3期ONCOLOGYPROGRESS,Feb2023Vol.21,No.3*病例报告*乳腺硬化性腺病伴低级别腺鳞癌乳腺硬化性腺病伴低级别腺鳞癌1例并文献复习例并文献复习毛昕,李红娜,胡倩岚,张爽,宋旭东#华北理工大学附属医院病理科,河北唐山0630000关键词关键词:乳腺硬化性腺病;乳腺低级别腺鳞癌;免疫组化中图分类号中图分类号:R737737.9文献标志码文献标志码:AdoiAdoi:10.11877/j.issn.1672-1535.2023.21.03.29乳腺低级别腺鳞癌是一种罕见的乳腺化生性癌,其生物学行为与其他化生性癌截然不同,具有较好的预后。乳腺低级别腺鳞癌合并乳腺硬化性腺病在临床更为罕见。本文对华北理工大学附属医院收治的1例乳腺硬化性腺病伴低级别腺鳞癌患者的临床资料及病理特征进行分析,并结合相关文献进行探讨。1病历资料病历资料患者女,43岁,主因发现右侧胸壁肿物半年余入院。查体:双乳对称,乳房皮肤未见明显异常,乳头未见内陷、偏斜、溢血及溢液。右乳腺内上象限近胸壁处可触及一大小约2.0cm×1.2cm的肿物,肿物较光滑,质地较硬,边界清楚。超声检查示:右乳腺内上象限距乳头5.0cm处探及一中低回声区,乳腺影像报告和数据系统(breastimagingre‐portinganddatasystem,BI-RADS)分级为3级,大小为2.2cm×1.1cm。钼靶检查示:右乳腺内上象限近胸壁区局限性不对称致密影,BI-RADS分级为3级。行右胸壁肿物切除术,术中右乳腺内上象限近胸壁处可见一直径约2.0cm的肿物,灰白,质硬,边界欠清。病理检查:①巨检。送检部分切除的乳腺组织大小为2.8cm×2.0cm×1.2cm,表面未见皮肤,组织切面灰黄,中心可见一灰白区,约1.2cm×1.1cm,质实,边界尚清。②镜检。病变范围局限,呈单节结状,界限较为清楚。整个结节均含纤维硬化性间质,结节一侧约2/3的区域在硬化背景中查见较多挤压变形的腺管,部分呈条索状,腺上皮缺乏异型性,表现为乳腺硬化性腺病的形态特点。结节内另外1/3的区域在硬化性间质中杂乱分布着拉长或逗点状腺管结构,部分细胞巢见鳞状分化,呈实性小巢浸润性生长,细胞巢周围可见淋巴细胞聚集(图1)。两种病变细胞的形态均温和,核分裂象罕见。伴鳞状分化的腺管或细胞巢与硬化性腺病中呈条索状挤压的部分腺管交错移行,移行区间质无明显变化,表现为纤维硬化性间质。③免疫组化。乳腺硬化性腺病区域内小管周围p63、钙调理蛋白(calponin)及CD10均为阳性,移行区部分腺管周围染色缺失。对侧病变区域内腺管及鳞状细胞分化癌巢雌激素...