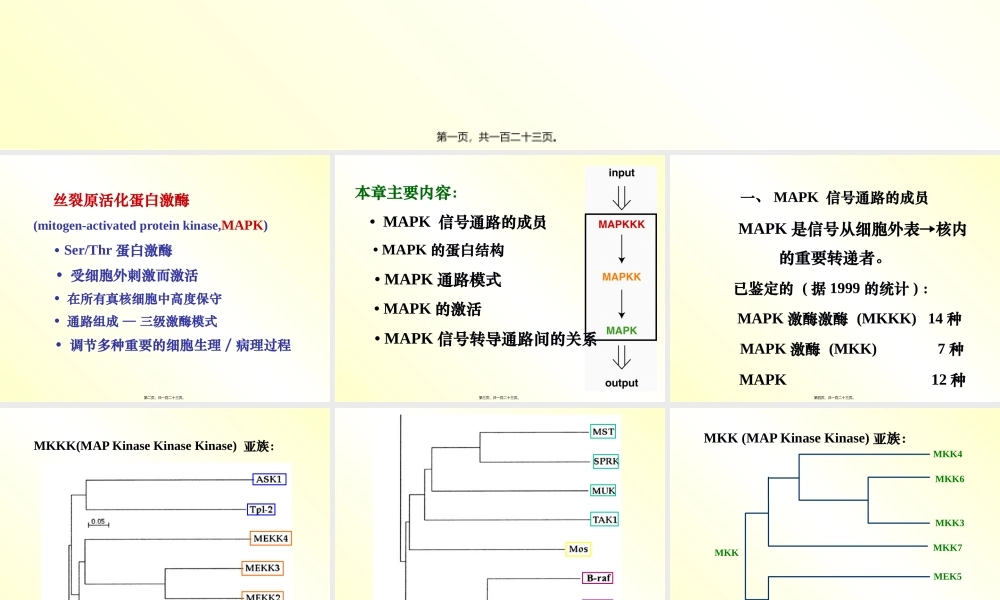
第九章丝裂原活化蛋白激酶信号转导通路第一页,共一百二十三页。丝裂原活化蛋白激酶(mitogen-activatedproteinkinase,MAPK)•Ser/Thr蛋白激酶•受细胞外刺激而激活•在所有真核细胞中高度保守•通路组成—三级激酶模式•调节多种重要的细胞生理/病理过程第二页,共一百二十三页。本章主要内容:•MAPK信号通路的成员•MAPK的蛋白结构•MAPK通路模式•MAPK的激活•MAPK信号转导通路间的关系第三页,共一百二十三页。一、MAPK信号通路的成员MAPK是信号从细胞外表→核内的重要转递者。已鉴定的(据1999的统计):MAPK激酶激酶(MKKK)14种MAPK激酶(MKK)7种MAPK12种第四页,共一百二十三页。MKKK(MAPKinaseKinaseKinase)亚族:第五页,共一百二十三页。第六页,共一百二十三页。MKK(MAPKinaseKinase)亚族:MEK5MEK2MEK1MKK7MKK4MKK6MKK3MKK第七页,共一百二十三页。MAPK(MAPKinase)亚族:ERK2ERK1ERK4ERK3ERK5JNK2JNK3JNK1第八页,共一百二十三页。JNK2JNK3JNK1p38βp38αp38δp38γ第九页,共一百二十三页。二、MAPK的蛋白结构〔一〕MAPK的一级结构苏氨酸磷酸化位点与其他蛋白激酶同源,酪氨酸磷酸化位点是MAPK独特的。磷酸化位点的三肽模体—TXYERK和ERK5—TEYp38—TGYJNK—TPY第十页,共一百二十三页。第十一页,共一百二十三页。•三肽模体位于L12•各亚族L12长度不同•活化唇(activationlip)•各亚族都具有12个保守亚区—真核细胞蛋白激酶超家族区分标志之一•家族成员之间具有较高的同源性第十二页,共一百二十三页。MAPK其他名称与ERK2的同源性%同一亚族成员序列相似性%ERK1p44MAPK88ERK2p42MAPK100ERK3αp62ratERK343100ERK3βhumanERK34274JNK1SAPKγ4087JNK2SAPKα41100JNK3SAPKβ4088哺乳动物MAPK第十三页,共一百二十三页。哺乳动物MAPKMAPK其他名称与ERK2的同源性%同一亚族成员序列相似性%ERK2p42MAPK100p38αp38CSBP50100p38βp38-24775p38γERK6SAPK34462p38δSAPK44264ERK5BMK151ERK741第十四页,共一百二十三页。第十五页,共一百二十三页。〔二〕MAPK的二级结构和超二级结构以ERK2为例N端域—主要由β折叠和2个α螺旋组成〔1~109和320~358位氨基酸残基〕C端域—α螺旋,含磷酸化唇和MAPK插入,催化环〔Arg-147~152)〔110~319位氨基酸残基〕交界处的裂隙—ATP结合位点第十六页,共一百二十三页。第十七页,共一百二十三页。第十八页,共一百二十三页。第十九页,共一百二十三页。〔三〕MAPK的空间结构特征大体结构:非常相似底物结合口袋...