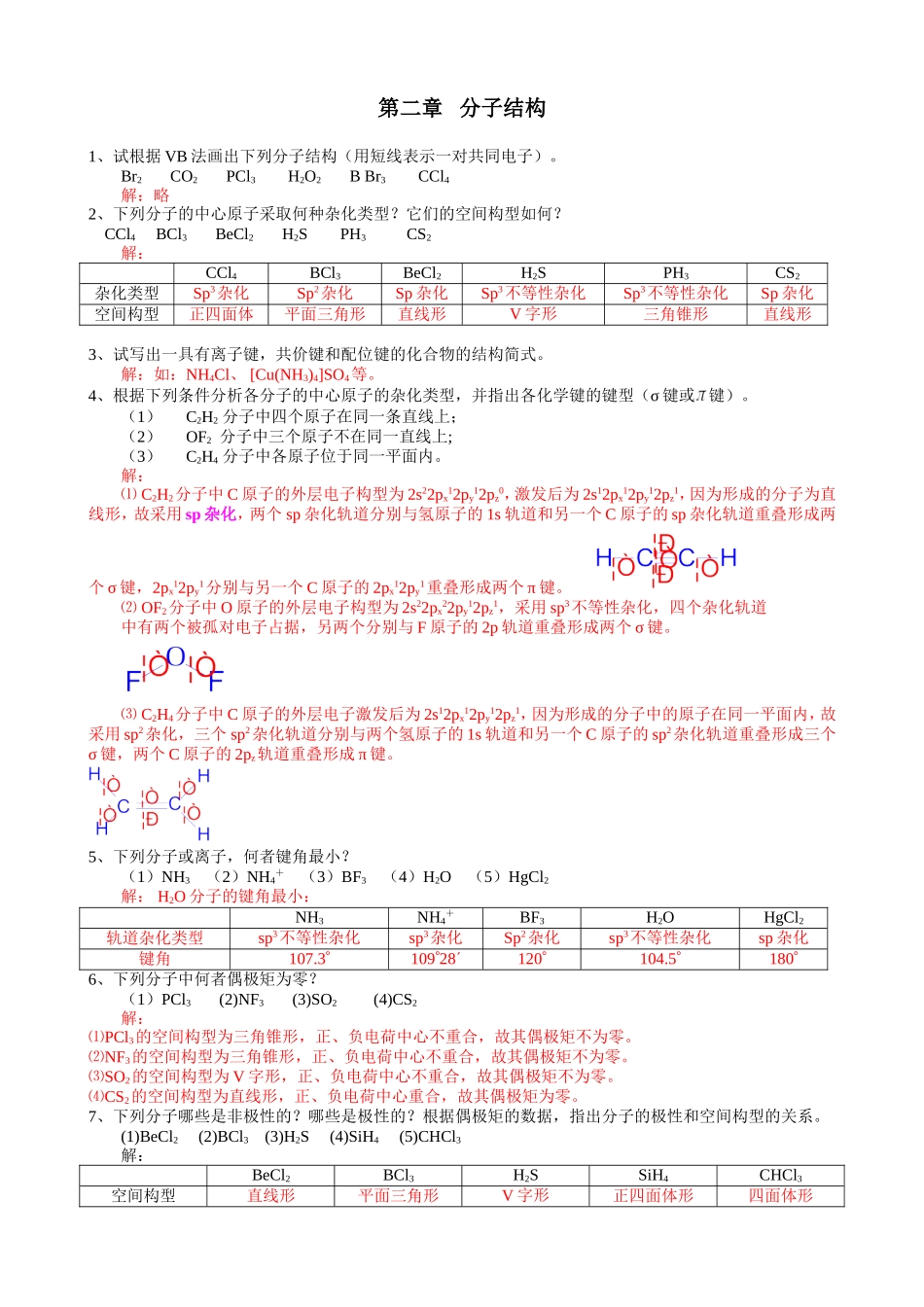
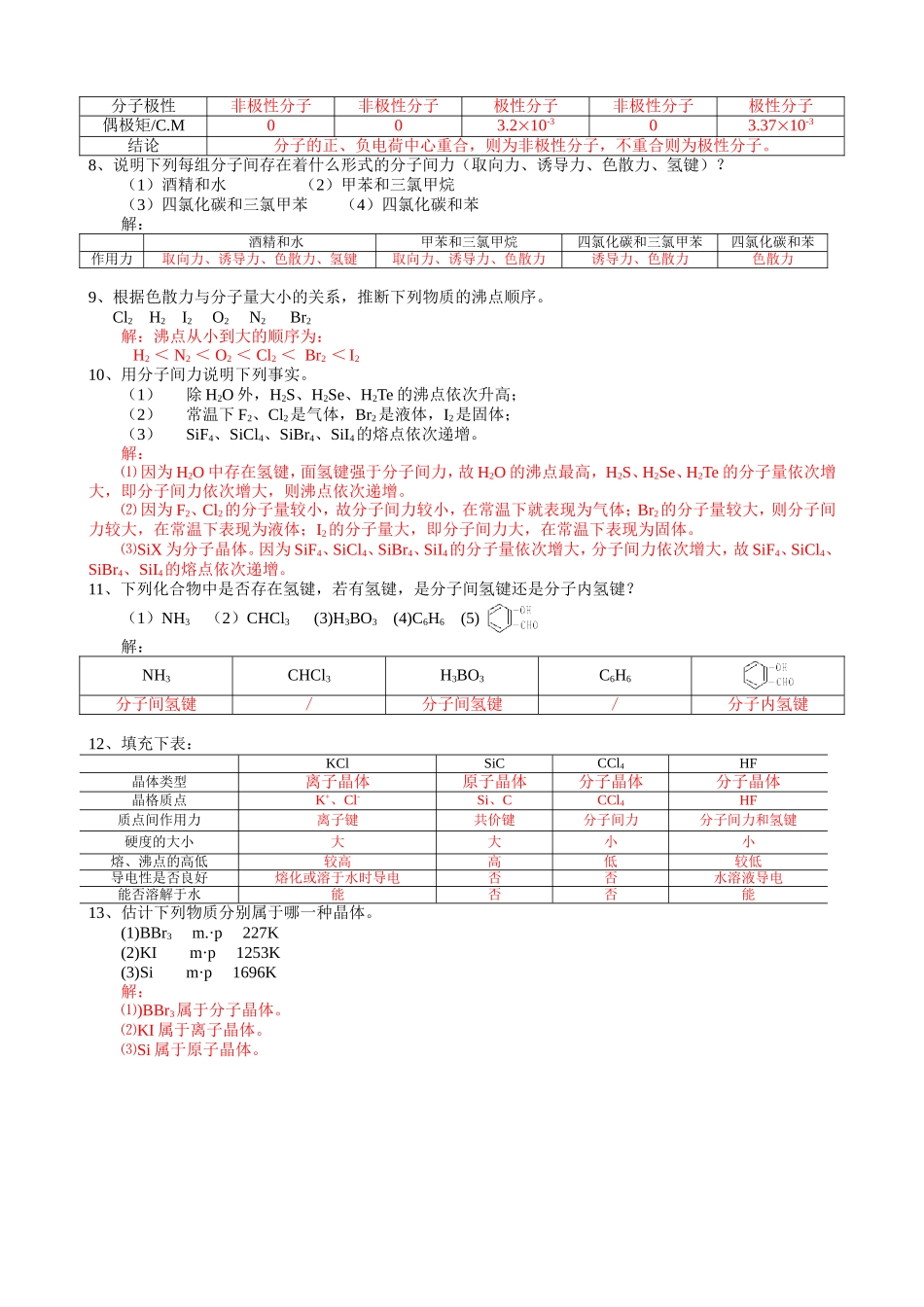
第二章分子结构1、试根据VB法画出下列分子结构(用短线表示一对共同电子)。Br2CO2PCl3H2O2BBr3CCl4解:略2、下列分子的中心原子采取何种杂化类型?它们的空间构型如何?CCl4BCl3BeCl2H2SPH3CS2解:CCl4BCl3BeCl2H2SPH3CS2杂化类型Sp3杂化Sp2杂化Sp杂化Sp3不等性杂化Sp3不等性杂化Sp杂化空间构型正四面体平面三角形直线形V字形三角锥形直线形3、试写出一具有离子键,共价键和配位键的化合物的结构简式。解:如:NH4Cl、[Cu(NH3)4]SO4等。4、根据下列条件分析各分子的中心原子的杂化类型,并指出各化学键的键型(σ键或键)。(1)C2H2分子中四个原子在同一条直线上;(2)OF2分子中三个原子不在同一直线上;(3)C2H4分子中各原子位于同一平面内。解:⑴C2H2分子中C原子的外层电子构型为2s22px12py12pz0,激发后为2s12px12py12pz1,因为形成的分子为直线形,故采用sp杂化,两个sp杂化轨道分别与氢原子的1s轨道和另一个C原子的sp杂化轨道重叠形成两个σ键,2px12py1分别与另一个C原子的2px12py1重叠形成两个π键。⑵OF2分子中O原子的外层电子构型为2s22px22py12pz1,采用sp3不等性杂化,四个杂化轨道中有两个被孤对电子占据,另两个分别与F原子的2p轨道重叠形成两个σ键。⑶C2H4分子中C原子的外层电子激发后为2s12px12py12pz1,因为形成的分子中的原子在同一平面内,故采用sp2杂化,三个sp2杂化轨道分别与两个氢原子的1s轨道和另一个C原子的sp2杂化轨道重叠形成三个σ键,两个C原子的2pz轨道重叠形成π键。5、下列分子或离子,何者键角最小?(1)NH3(2)NH4+(3)BF3(4)H2O(5)HgCl2解:H2O分子的键角最小:NH3NH4+BF3H2OHgCl2轨道杂化类型sp3不等性杂化sp3杂化Sp2杂化sp3不等性杂化sp杂化键角107.310928120104.51806、下列分子中何者偶极矩为零?(1)PCl3(2)NF3(3)SO2(4)CS2解:⑴PCl3的空间构型为三角锥形,正、负电荷中心不重合,故其偶极矩不为零。⑵NF3的空间构型为三角锥形,正、负电荷中心不重合,故其偶极矩不为零。⑶SO2的空间构型为V字形,正、负电荷中心不重合,故其偶极矩不为零。⑷CS2的空间构型为直线形,正、负电荷中心重合,故其偶极矩为零。7、下列分子哪些是非极性的?哪些是极性的?根据偶极矩的数据,指出分子的极性和空间构型的关系。(1)BeCl2(2)BCl3(3)H2S(4)SiH4(5)CHCl3解:BeCl2BCl3H2SSiH4CHCl3空间构型直线形平面三角形V字形正四面体形四面体形分子极性非极性分子非极性分子极性分子非极性分子极性分...