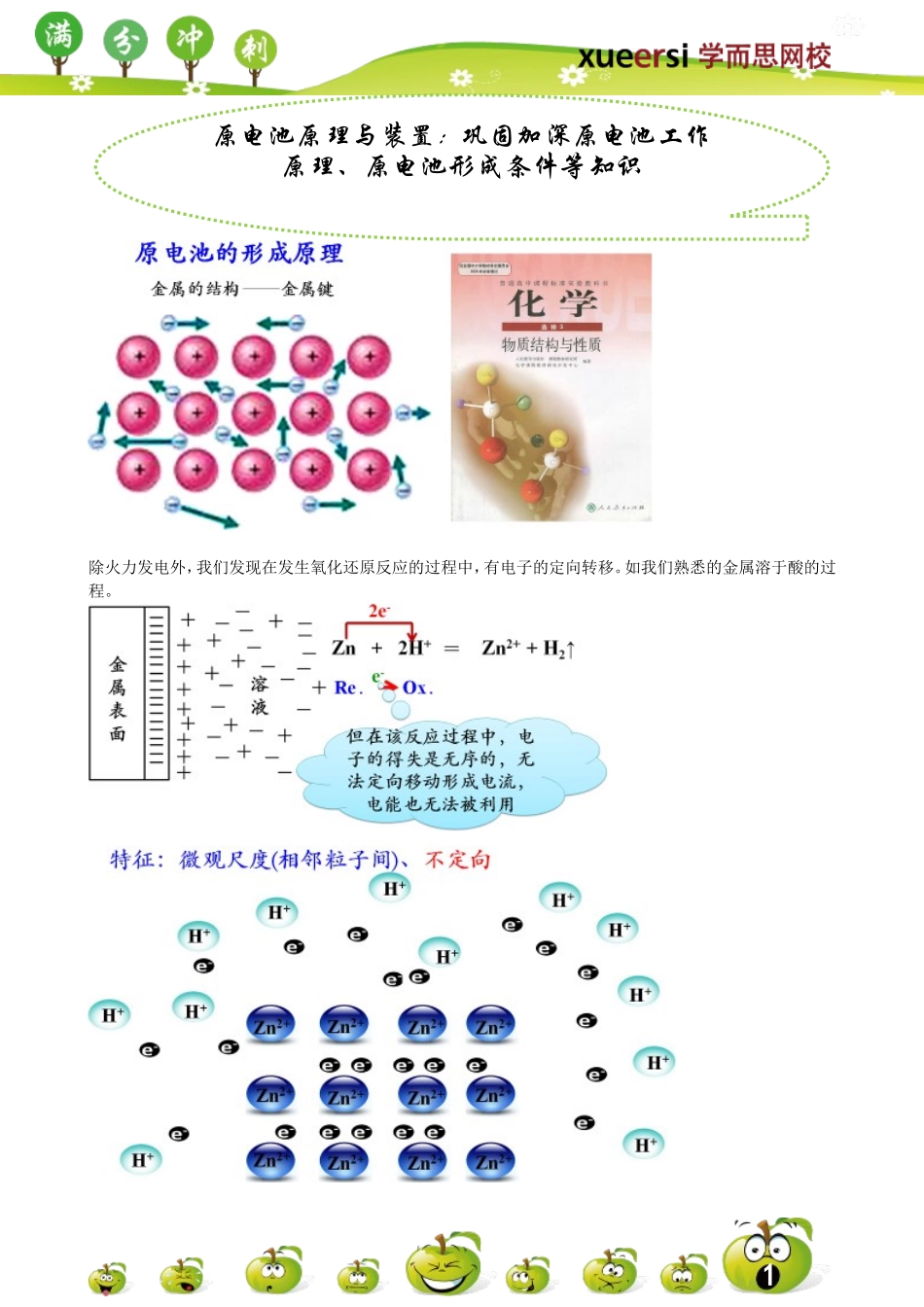
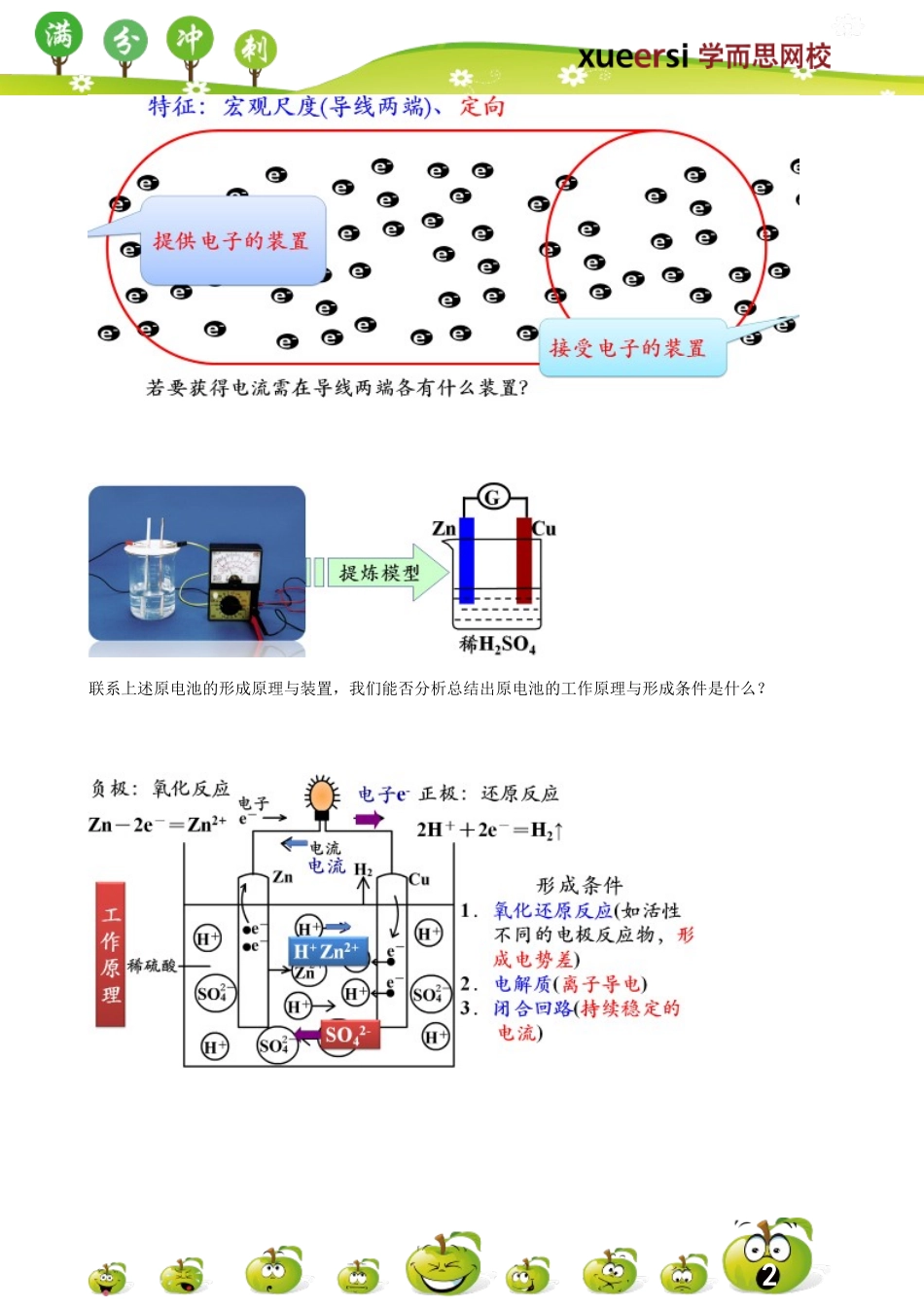
1除火力发电外,我们发现在发生氧化还原反应的过程中,有电子的定向转移。如我们熟悉的金属溶于酸的过程。原电池原理与装置:巩固加深原电池工作原理、原电池形成条件等知识2联系上述原电池的形成原理与装置,我们能否分析总结出原电池的工作原理与形成条件是什么?3普通氧化还原反应与原电池反应的联系与区别【例1】在下图的8个装置中,属于原电池的是()【例2】由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH怎样变化()A.不变B.先变小后变大C.逐渐变大D.逐渐变小4【例3】下列关于铜—锌—稀H2SO4构成的原电池的有关叙述中错误的是()A.锌为负极,锌发生氧化反应B.铜为正极,铜不易失去电子而受到保护C.负极发生还原反应,正极发生氧化反应D.外电路电子流入的一极为正极,电子流出的一极为负极【例4】下列关于原电池的叙述正确的是()A.构成原电池的正极和负极必须是两种不同的金属B.原电池是将化学能转变为电能的装置C.在原电池中,电子流出的一极是负极,该电极被还原D.原电池放电时,电流的方向是从负极到正极【例5】某同学设计实验探究构成原电池的条件,装置如下:实验一:实验探究电极的构成〈甲图〉①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③A极用锌片,B极用铜片,发现电流计指针向左偏转;④A极用锌片,B极用石墨,发现电流计指针向左偏转。结论一:__________________________________。实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)①液体采用无水乙醇,发现电流计指针不偏转;②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。结论二:____________________________________。实验三:对比实验,探究乙图装置能否构成原电池将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转。结论三:____________________________________。思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。⑴在甲图装置中,若A为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向_______偏转。⑵一根金属丝两端分别放在图乙的两个烧杯之中,电流计指针_______(填“能”或“不能”)偏转。【例6】⑴若烧杯中溶液为稀硫酸,则观察到的现象。正极反应式为:;负极反应式为:。该装置将能转化为能。⑵若烧杯中溶液为氢氧化钠溶液,则负极为,5负电极反应式为:正极为:,正电极反应式为:总反应方程式...