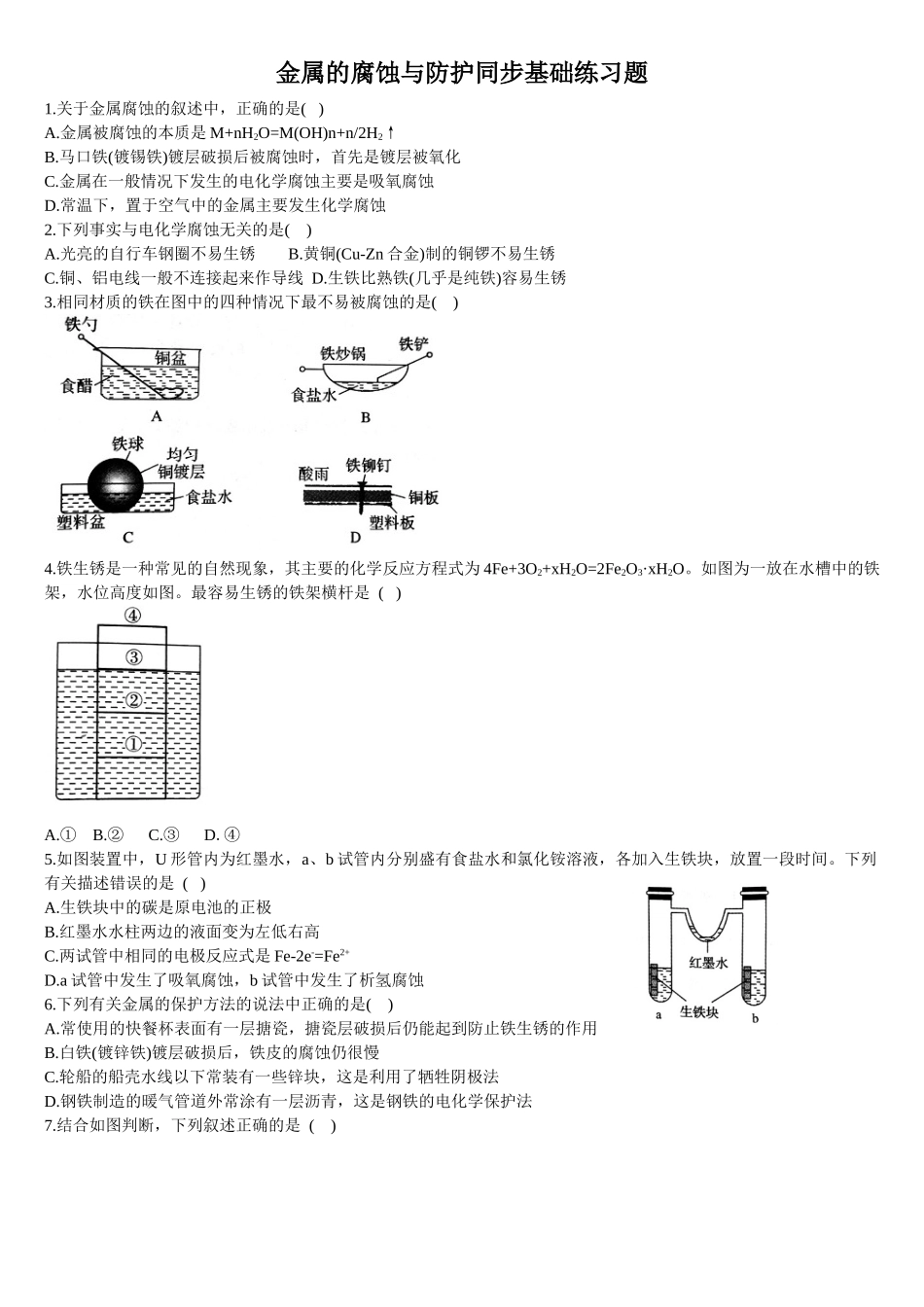
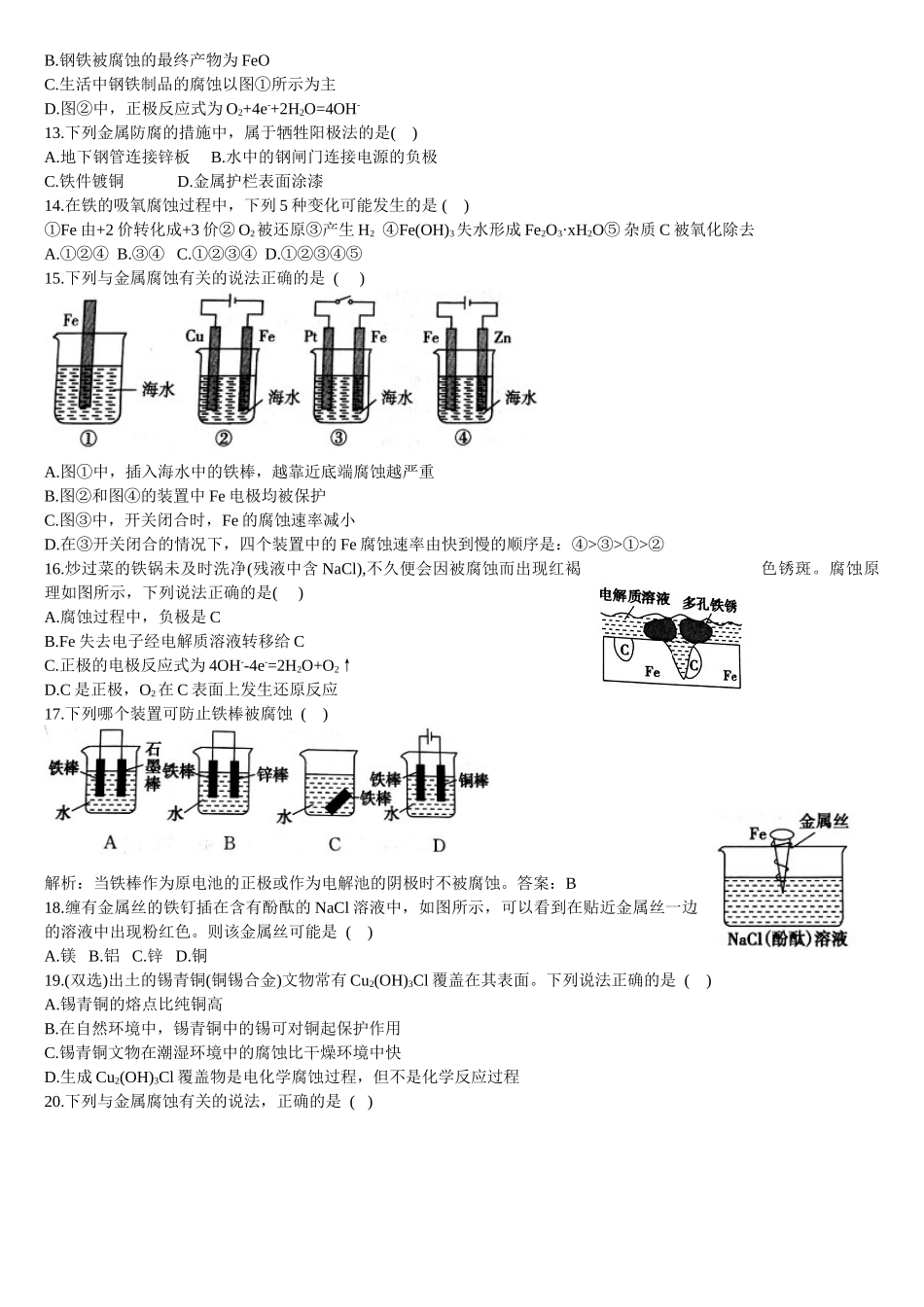
金属的腐蚀与防护同步基础练习题1.关于金属腐蚀的叙述中,正确的是()A.金属被腐蚀的本质是M+nH2O=M(OH)n+n/2H2↑B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀D.常温下,置于空气中的金属主要发生化学腐蚀2.下列事实与电化学腐蚀无关的是()A.光亮的自行车钢圈不易生锈B.黄铜(Cu-Zn合金)制的铜锣不易生锈C.铜、铝电线一般不连接起来作导线D.生铁比熟铁(几乎是纯铁)容易生锈3.相同材质的铁在图中的四种情况下最不易被腐蚀的是()4.铁生锈是一种常见的自然现象,其主要的化学反应方程式为4Fe+3O2+xH2O=2Fe2O3·xH2O。如图为一放在水槽中的铁架,水位高度如图。最容易生锈的铁架横杆是()A.①B.②C.③D.④5.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是()A.生铁块中的碳是原电池的正极B.红墨水水柱两边的液面变为左低右高C.两试管中相同的电极反应式是Fe-2e-=Fe2+D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀6.下列有关金属的保护方法的说法中正确的是()A.常使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀仍很慢C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极法D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法7.结合如图判断,下列叙述正确的是()A.I和Ⅱ中正极均被保护B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀8.如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片。观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面。以下有关解释合理的是()A.生铁片中的碳是原电池的负极,发生还原反应B.雨水酸性较强,生铁片仅发生析氢腐蚀C.墨水回升时,碳极反应式为O2+2H2O+4e-=4OH-D.具支试管中溶液pH逐渐减小9.为了防止钢铁锈蚀,下列防护方法中正确的是()A.在精密机床的铁床上安装铜螺钉B.在排放海水的钢铁闸门上用导线连接一块石墨,一同浸入海水中C.在海轮舷上用铁丝系住锌板浸在海水里D.在地下输油的铸铁管上接直流电源的正极10.下列与金属腐蚀有关的说法正确的是()A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小C.图c中,接通开关时Zn腐蚀速率...