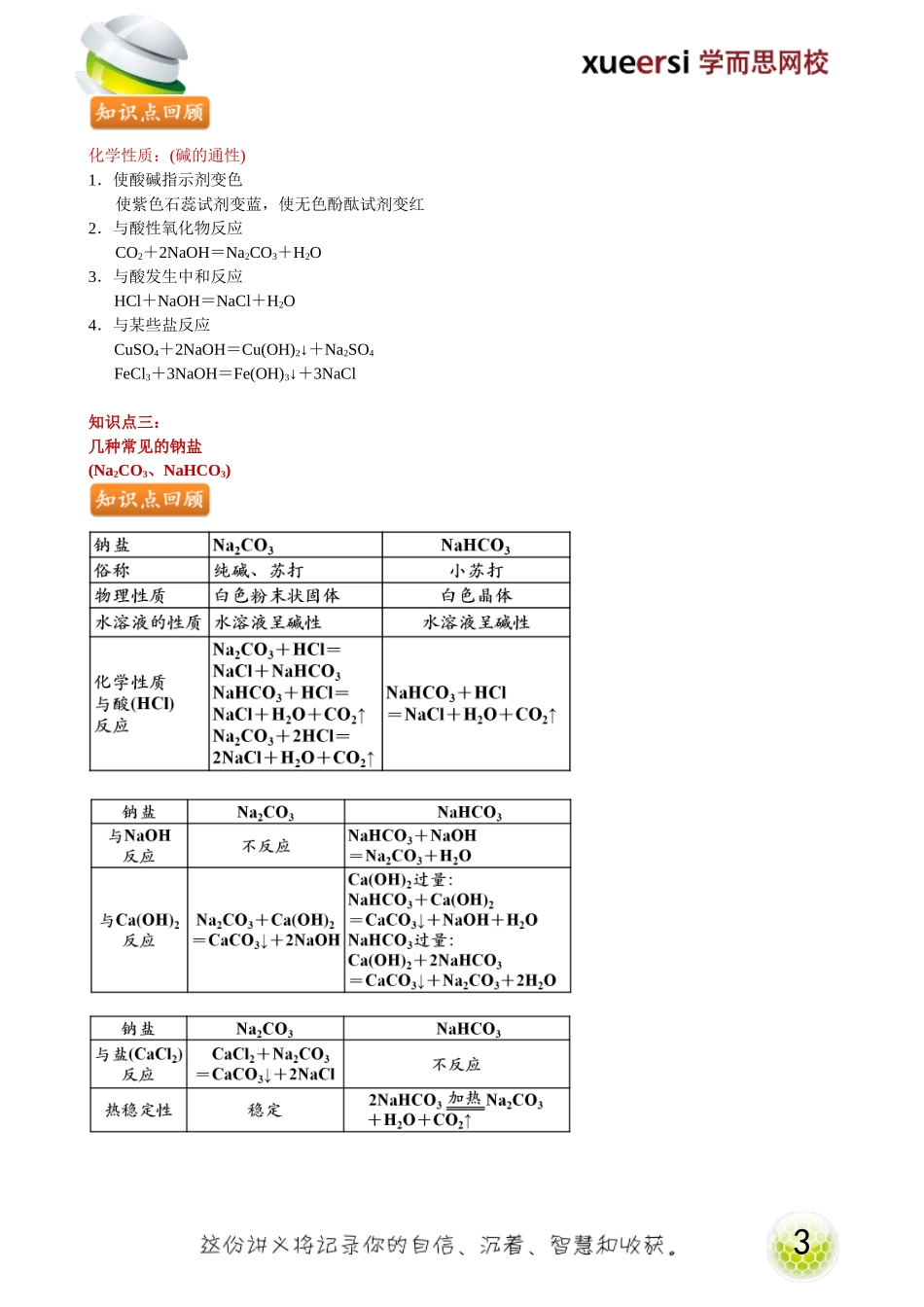
1第一部分:金属钠知识点一:钠的原子结构示意图知识点二:单质钠的化学性质推测1.最外层一个电子,易失去最外层的一个电子,表现出较强的失电子能力,从而具有较强的还原性。2.钠元素的可能化合价有0,+1价,单质中钠元素的化合价为0价处于最低价态故单质钠应该只有还原性。知识点三:单质钠的性质1.物理性质:银白色,有金属光泽,金属;熔点低、硬度小;密度比水小比煤油大。2.化学性质(还原性):B.与水反应实验现象:“浮、球、气、游、红”“浮”:说明钠的密度比水小“球”:说明钠的熔点低且钠与水反应是放热反应“气、游”:说明有气体生成“红”:说明反应后的溶液呈碱性钠和钠的化合物2反应方程式:2Na+2H2O=2NaOH+H2↑C.与盐溶液反应与硫酸铜溶液反应:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4与氯化铁溶液反应:2Na+2H2O=2NaOH+H2↑3NaOH+FeCl3=Fe(OH)3↓+3NaClD.与酸反应与盐酸反应:2Na+2HCl=2NaCl+H2↑与冰醋酸反应:2Na+2CH3COOH=2CH3COONa+H2↑第二部分:钠的化合物知识点一:钠的氧化物(Na2O、Na2O2)1.物理性质:Na2O:白色固体Na2O2:淡黄色固体2.化学性质:A.与强酸反应:Na2O+2HCl=2NaCl+H2O2Na2O2+4HCl=4NaCl+2H2O+O2↑B.与水反应:Na2O+H2O=2NaOH2Na2O2+2H2O=4NaOH+O2↑C.与二氧化碳反应:Na2O+CO2=Na2CO32Na2O2+2CO2=2Na2CO3+O2碱性氧化物:与酸反应只生成盐和水的氧化物。(通常为金属氧化物)结论:Na2O是碱性氧化物,Na2O2不是碱性氧化物。知识点二:钠的氢氧化物(NaOH)3化学性质:(碱的通性)1.使酸碱指示剂变色使紫色石蕊试剂变蓝,使无色酚酞试剂变红2.与酸性氧化物反应CO2+2NaOH=Na2CO3+H2O3.与酸发生中和反应HCl+NaOH=NaCl+H2O4.与某些盐反应CuSO4+2NaOH=Cu(OH)2↓+Na2SO4FeCl3+3NaOH=Fe(OH)3↓+3NaCl知识点三:几种常见的钠盐(Na2CO3、NaHCO3)4相互转化溶液中:NaHCO3+NaOH=Na2CO3+H2O固体时:第三部分:例题精讲【例1】取一小块钠放在玻璃燃烧匙里加热,下列实验现象正确的是()①金属先熔化②在空气中燃烧火焰呈黄色③燃烧时火星四射④燃烧后生成淡黄色固体⑤燃烧后生成白色固体A.①②③B.①②④C.①②⑤D.①③⑤【例2】把一小块钠投入盛有煤油和水的烧杯中,可观察到的现象是()A.钠浮在烧杯中的液面以上B.钠沉在烧杯的底部C.钠会在水和煤油的交界面上下浮动,直到反应结束D.煤油会燃烧,产生浓的黑烟【例3】金属钠着火后...