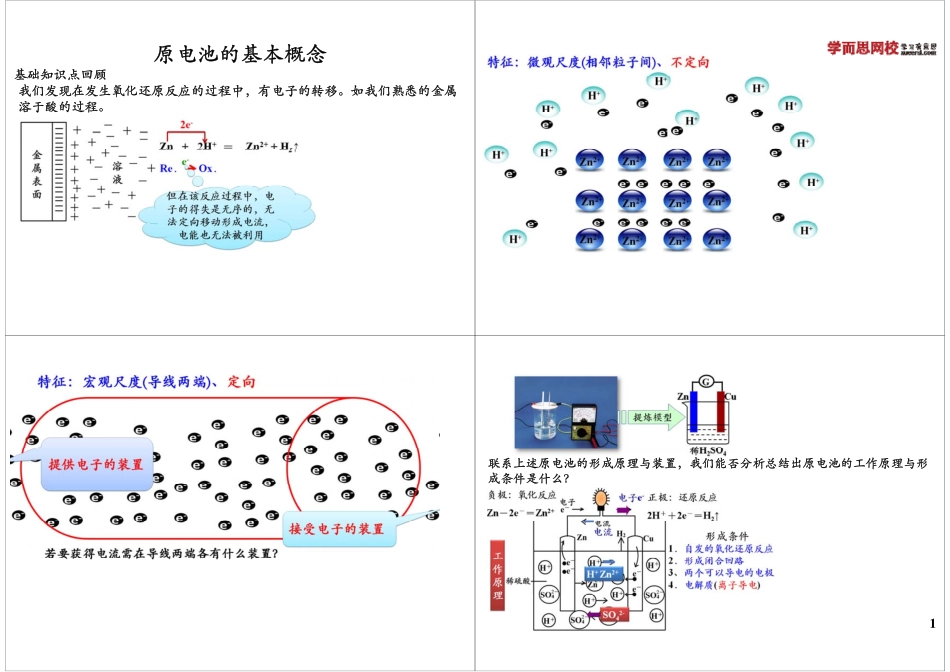
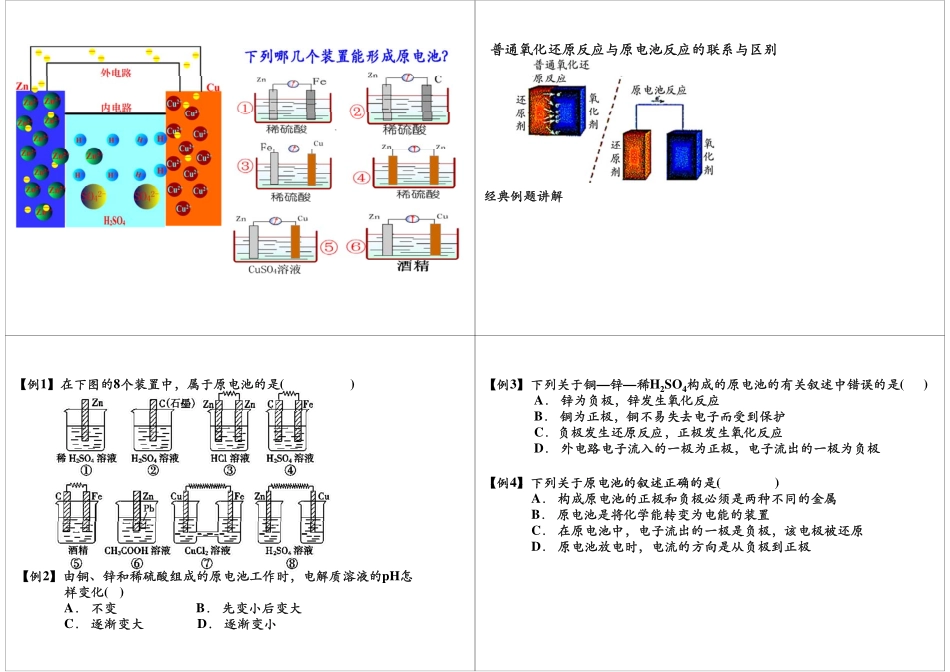
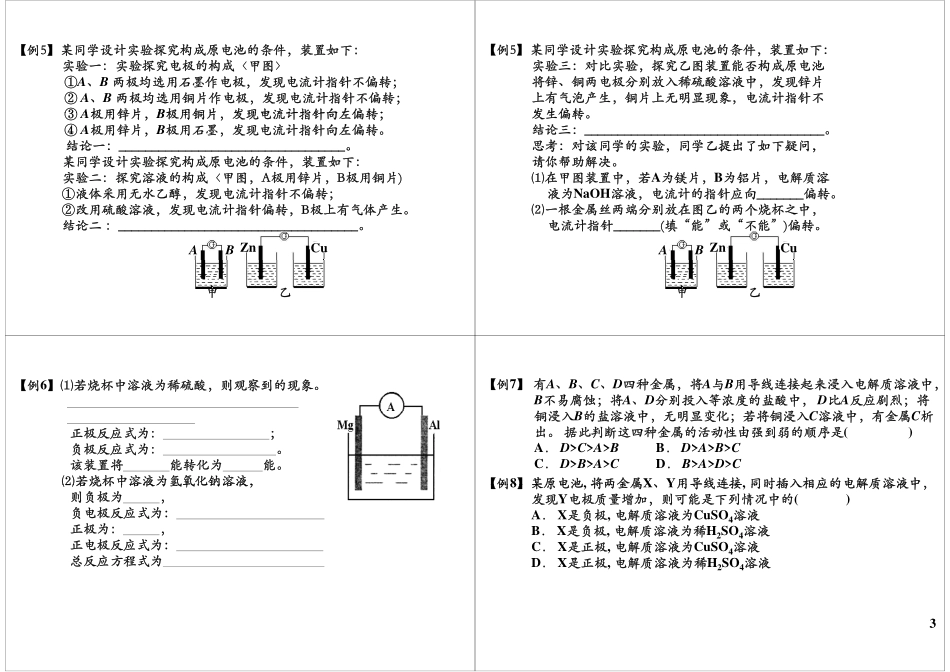
原电池的基本概念基础知识点回顾基础知识点回顾我们发现在发生氧化还原反应的过程中,有电子的转移。如我们熟悉的金属溶于酸的过程。联系上述原电池的形成原理与装置,我们能否分析总结出原电池的工作原理与形成条件是什么?1普通氧化还原反应与原电池反应的联系与区别经典例题讲解【例1】在下图的8个装置中,属于原电池的是()【例2】由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH怎样变化()样变化()A.不变B.先变小后变大C.逐渐变大D.逐渐变小【例3】下列关于铜—锌—稀H2SO4构成的原电池的有关叙述中错误的是()A.锌为负极,锌发生氧化反应铜为极铜易失去电受到保护B.铜为正极,铜不易失去电子而受到保护C.负极发生还原反应,正极发生氧化反应D外电路电子流入的一极为正极电子流出的一极为负极D.外电路电子流入的一极为正极,电子流出的一极为负极【例4】下列关于原电池的叙述正确的是()【例4】下列关于原电池的叙述正确的是()A.构成原电池的正极和负极必须是两种不同的金属B.原电池是将化学能转变为电能的装置C.在原电池中,电子流出的一极是负极,该电极被还原D.原电池放电时,电流的方向是从负极到正极【例5】某同学设计实验探究构成原电池的条件,装置如下:实验一:实验探究电极的构成〈甲图〉①A、B两极均选用石墨作电极,发现电流计指针不偏转;②A、B两极均选用铜片作电极,发现电流计指针不偏转;③A极用锌片B极用铜片发现电流计指针向左偏转;③A极用锌片,B极用铜片,发现电流计指针向左偏转;④A极用锌片,B极用石墨,发现电流计指针向左偏转。结论一:。结论:__________________________________。某同学设计实验探究构成原电池的条件,装置如下:实验二:探究溶液的构成〈甲图,A极用锌片,B极用铜片)①液体采用无水乙醇,发现电流计指针不偏转;②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生。结论二结论二:____________________________________。CuZnBA甲乙【例5】某同学设计实验探究构成原电池的条件,装置如下:实验三:对比实验,探究乙图装置能否构成原电池将极放稀中发片将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转发生偏转。结论三:____________________________________。思考:对该同学的实验,同学乙提出了如下疑问,思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决。⑴在甲图装置中,若A为镁片,B为铝片,电解质溶液...