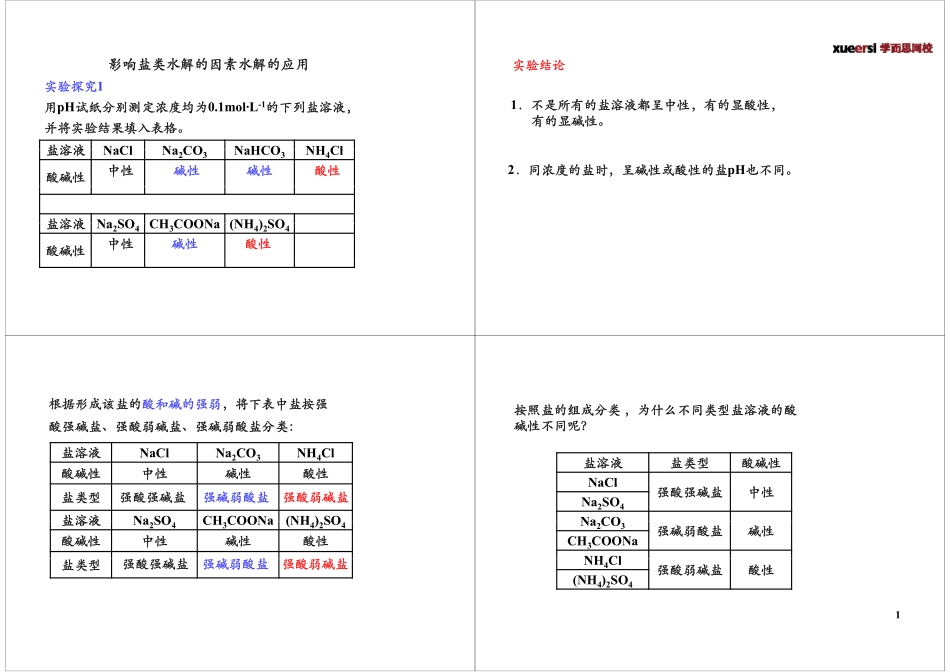
影响盐类水解的因素水解的应用实验探究1用pH试纸分别测定浓度均为0.1mol·L-1的下列盐溶液,用p均,并将实验结果填入表格。盐溶液NaClNaCONaHCONHCl盐溶液NaClNa2CO3NaHCO3NH4Cl酸碱性碱性酸性中性碱性盐溶液NaSOCHCOONa(NH)SO盐溶液Na2SO4CH3COONa(NH4)2SO4酸碱性中性酸性碱性实验结论1.不是所有的盐溶液都呈中性,有的显酸性,有的显碱性。2.同浓度的盐时,呈碱性或酸性的盐pH也不同。根据形成该盐的酸和碱的强弱,将下表中盐按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类:盐溶液盐溶液NaClNa2CO3NH4Cl酸碱性中性碱性酸性盐类型盐溶液NaSOCHCOONa(NH)SO强酸强碱盐强碱弱酸盐强酸弱碱盐盐溶液Na2SO4CH3COONa(NH4)2SO4酸碱性中性碱性酸性盐盐盐盐类型强酸强碱盐强碱弱酸盐强酸弱碱盐按照盐的组成分类为什么不同类型盐溶液的酸按照盐的组成分类,为什么不同类型盐溶液的酸碱性不同呢?盐溶液盐类型酸碱性NaClNaCl强酸强碱盐中性Na2SO4NaCONa2CO3强碱弱酸盐碱性CH3COONaNHClNH4Cl强酸弱碱盐酸性(NH4)2SO41下列盐溶于水后微观的变化NHClNHCl44NHClNHCl2HOOHH��+溶液中c(H+)>c(OH-),显酸性。本质是弱碱阳离子与水电离出的�NH3·H2O阳离子与水电离出的OH-作用生成弱电解质。4232NHClHONHHOHCl�4232NHHONHHOH�4232下列盐溶于水后微观的变化CHCOONaCHCOONa33CHCOONaCHCOONa2HOHOH��+溶液中c(H+)<c(OH-),显碱性。本质是弱酸阴离子与水电离出的�CH3COOHCCOOOCCOOO阴离子与水电离出的H+作用生成弱电解质。323CHCOONaHOCHCOOHNaOH�323CHCOOHOCHCOOHOH�盐类的水解1.定义:在溶液中盐电离出来的阳离子、阴离子(弱酸阴离子或弱碱阳离子)跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。解,解2.结合盐类水解的定义分析盐类水解的实质⑴盐的离子和水电离出来的H+或OH-结合生成弱酸或弱碱。(生成弱电解质)⑵盐的离子使水的电离平衡移动,使盐溶液显示不同⑵盐的离子使水的电离平衡移动,使盐溶液显示不同程度的酸性、碱性。(破坏水的电离平衡-----促进水的电离)(破坏水的电离平衡-----促进水的电离)3.盐类水解反应与中和反应的关系盐类水解是中和反应的逆反应4.盐类的水解规律2盐水解的表示方法——水解方程式1.不同类型盐的水解方程式的书写:⑴一元弱酸强碱盐:如CH3COONa3⑵一元弱碱强酸盐:如NH4Cl⑶多元弱酸强碱的正盐:如Na2CO323⑷多元弱碱强酸盐:如AlC...