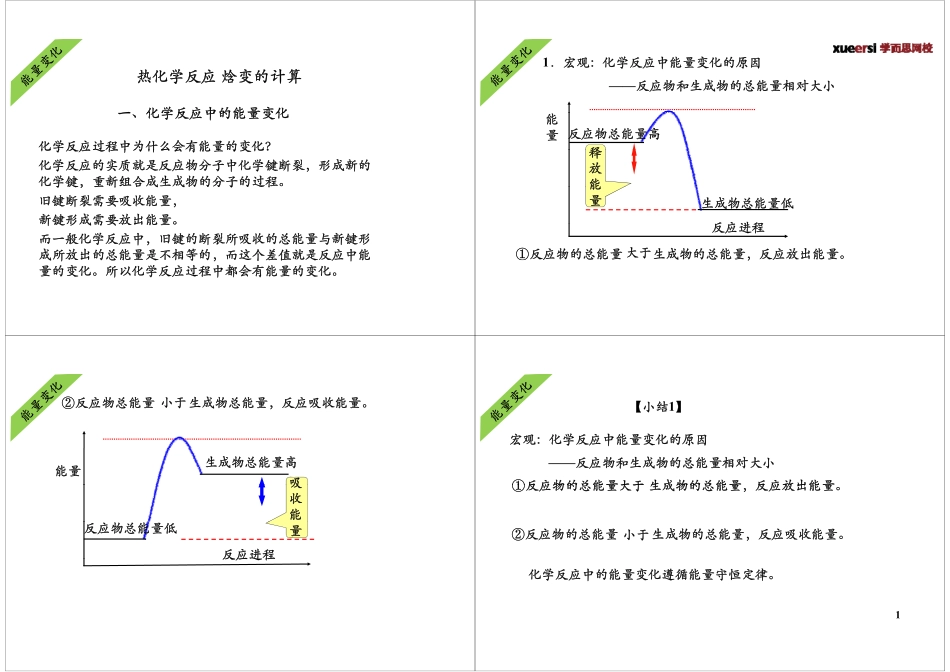
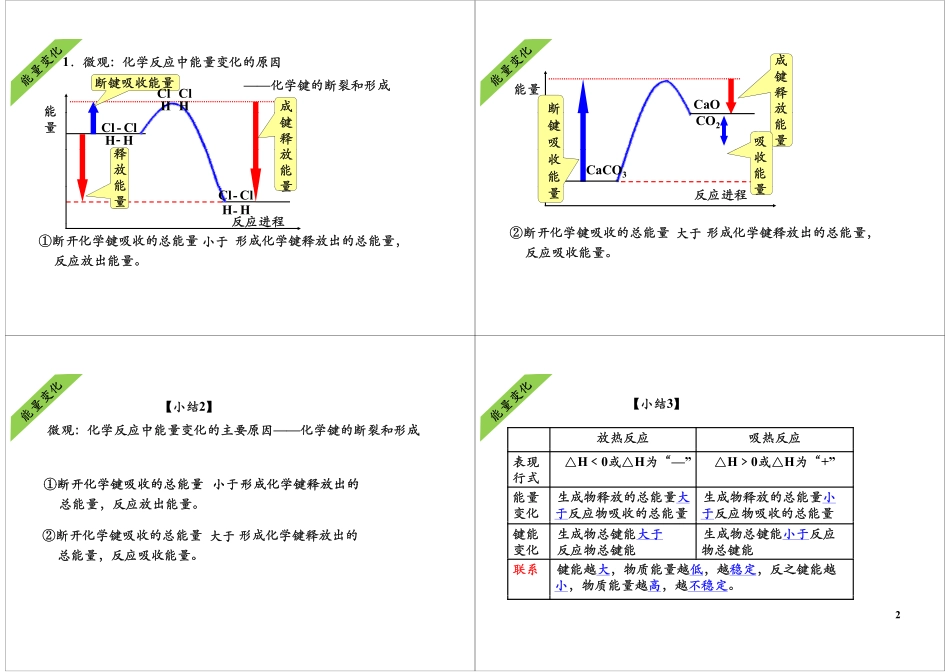
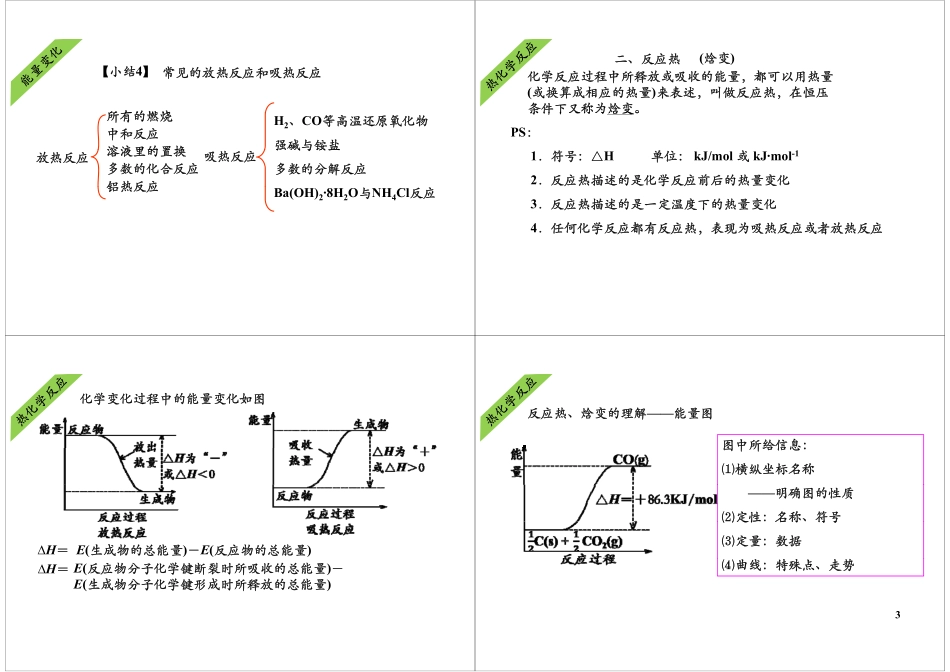
热化学反应焓变的计算一化学反应中的能量变化热化学反应焓变的计算化学反应过程中为什么会有能量的变化?一、化学反应中的能量变化化学反应过程中为什么会有能量的变化?化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子的过程。学键,重新合成成物的分子的过程旧键断裂需要吸收能量,新键形成需要放出能量。新键形成需要放出能量。而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能成所的总能是相等的,个差值是应中能量的变化。所以化学反应过程中都会有能量的变化。1.宏观:化学反应中能量变化的原因——反应物和生成物的总能量相对大小反应物总能量高能量释释放能生成物总能量低反应进程能量反应进程①反应物的总能量生成物的总能量,反应放出能量。大于,②反应物总能量生成物总能量,反应吸收能量。小于能量生成物总能量高吸吸收能反应进程反应物总能量低量反应进程【小结1】【小结】宏观:化学反应中能量变化的原因——反应物和生成物的总能量相对大小①反应物的总能量生成物的总能量反应放出能量大于①反应物的总能量生成物的总能量,反应放出能量。大于②反应物的总能量生成物的总能量,反应吸收能量。小于化学反应中的能量变化遵循能量守恒定律。11.微观:化学反应中能量变化的原因——化学键的断裂和形成能断键吸收能量成HClClH能量键释放HClClH--释放能量释放能反应进程量--能量HClClH①断开化学键吸收的总能量形成化学键释放出的总能量,反应放出能量反应进程小于反应放出能量。成键能量键释放断CaO放能量吸断键吸CO2CaCO3收能量收能反应进程量量②断开化学键吸收的总能量形成化学键释放出的总能量,反应吸收能量。大于【小结2】【小结】微观:化学反应中能量变化的主要原因——化学键的断裂和形成①断开化学键吸收的总能量形成化学键释放出的小于①断开化学键吸收的总能量形成化学键释放出的总能量,反应放出能量。小于②断开化学键吸收的总能量形成化学键释放出的总能量,反应吸收能量。大于总能量,反应吸收能量。【小结3】放热反应吸热反应表现行式△H﹤0或△H为“—”△H﹥0或△H为“+”能量变化生成物释放的总能量大于反应物吸收的总能量生成物释放的总能量小于反应物吸收的总能量键能变化生成物总键能大于反应物总键能生成物总键能小于反应物总键能联系键能越大,物质能量越低,越稳定,反之键能越小,物质能量越高,越不稳定。2常...