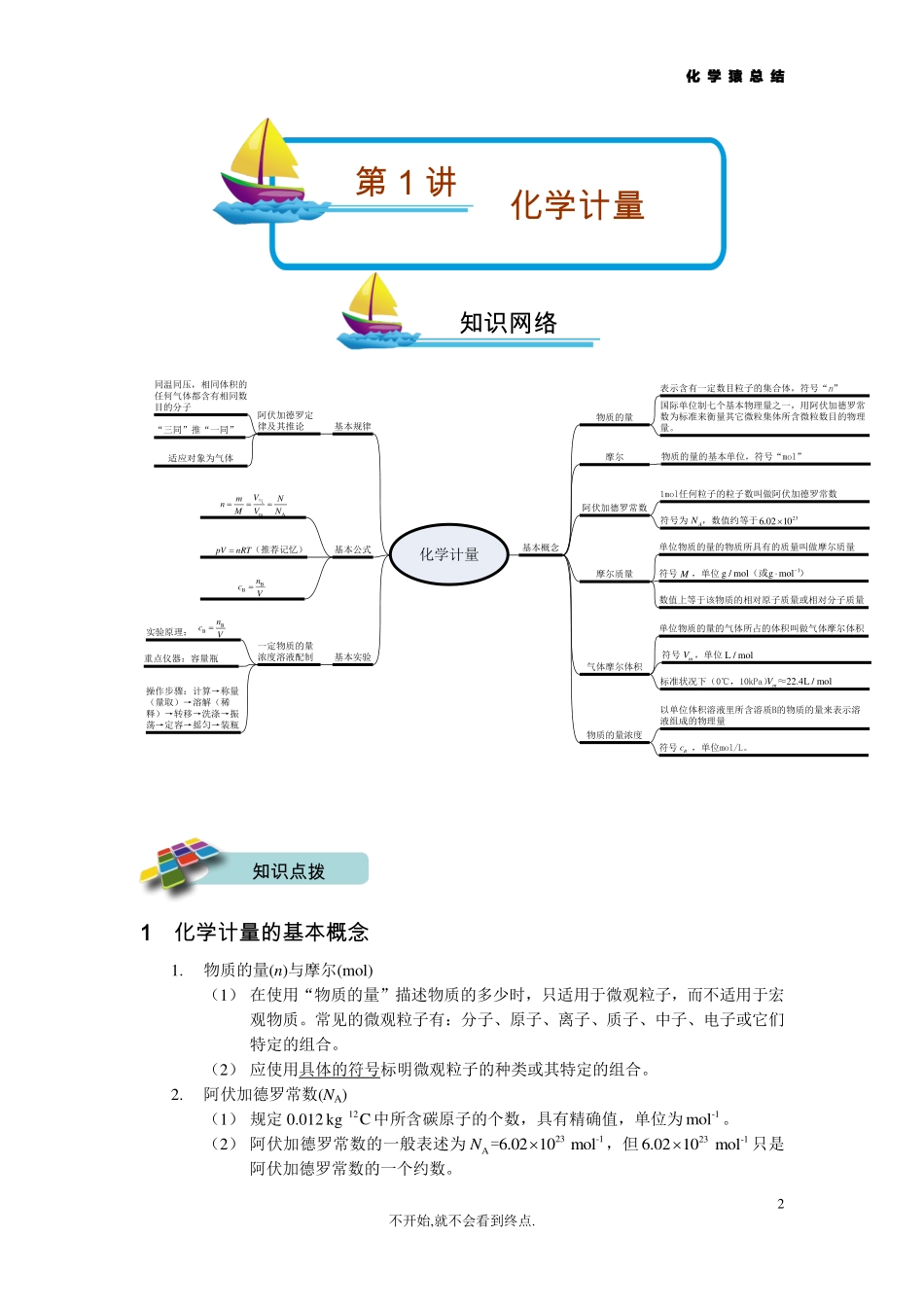
化学猿总结2不开始,就不会看到终点.化学计量基本概念基本实验基本规律基本公式物质的量阿伏加德罗常数摩尔质量气体摩尔体积物质的量浓度阿伏加德罗定律及其推论一定物质的量浓度溶液配制摩尔mAVmNnMVN气(推荐记忆)pVnRTBBncV表示含有一定数目粒子的集合体,符号“n”国际单位制七个基本物理量之一,用阿伏加德罗常数为标准来衡量其它微粒集体所含微粒数目的物理量。物质的量的基本单位,符号“mol”1mol任何粒子的粒子数叫做阿伏加德罗常数AN236.0210符号为,数值约等于单位物质的量的物质所具有的质量叫做摩尔质量符号,单位数值上等于该物质的相对原子质量或相对分子质量M1g/molgmol(或)mVL/mol单位物质的量的气体所占的体积叫做气体摩尔体积符号,单位标准状况下(0℃,10kPa)22.4L/molmV≈以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量符号,单位mol/L。实验原理:重点仪器:容量瓶操作步骤:计算→称量(量取)→溶解(稀释)→转移→洗涤→振荡→定容→摇匀→装瓶同温同压,相同体积的任何气体都含有相同数目的分子“三同”推“一同”适应对象为气体BBncVBc1化学计量的基本概念1.物质的量(n)与摩尔(mol)(1)在使用“物质的量”描述物质的多少时,只适用于微观粒子,而不适用于宏观物质。常见的微观粒子有:分子、原子、离子、质子、中子、电子或它们特定的组合。(2)应使用具体的符号标明微观粒子的种类或其特定的组合。2.阿伏加德罗常数(NA)(1)规定0.012kg12C中所含碳原子的个数,具有精确值,单位为-1mol。(2)阿伏加德罗常数的一般表述为23-1A6.0210molN=,但236.0210-1mol只是阿伏加德罗常数的一个约数。知识网络知识点拨第1讲化学计量化学猿总结3不开始,就不会看到终点.3.摩尔质量(M)(1)注意区分“相对分子(原子)质量”与“摩尔质量”的区别,摩尔质量(g/mol)在数值上等于该物质的相对原子质量或相对分子质量,但二者的意义并不相同。相对分子(原子)质量是指该物质一个粒子(或单位组成)的质量与一个12C原子的1/12之比所得的数值,单位是1;摩尔质量是单位物质的量的物质所具有的质量,单位是1g/molgmol(或)。(2)1mol某混合物的质量在数值上等于其平均摩尔质量,以1gmol为单位时,数值上等于该混合物的平均相对分子质量。4.气体摩尔体积(Vm)(1)使用气体摩尔体积时,一定要确认该物质在该状态下是否为气态。(2)气体的摩尔体积不仅适用于纯净气体,也适用于混合气体...