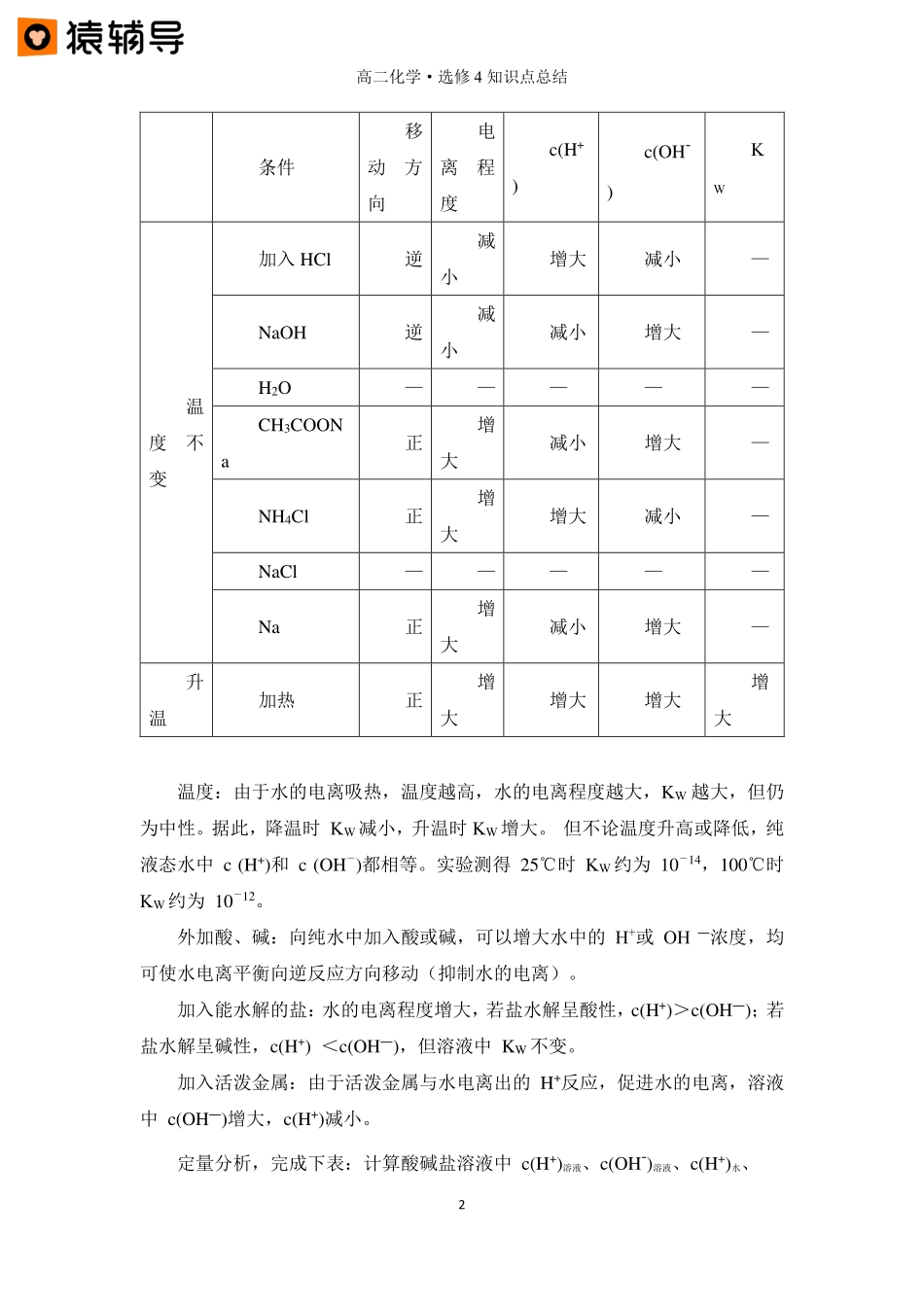
高二化学·选修4知识点总结1第七讲水溶液中的水的电离与pH一、水的电离1.水的电离(1)水是一种极弱的电解质,它能微弱电离:在纯水或水溶液中:H2O⇋H++OH—;△H>0或:2H2O⇋H3O++OH―;ΔH>0。(2)水的电离的特点①水分子与水分子之间相互作用引起水的电离。②极难电离,通常只有极少数水分子电离。③由水电离出的H+和OH―数目相等。④水的电离是吸热的、可逆的。2.水的离子积常数一定温度下,由水电离出的c(H+)与c(OH―)的乘积是一个常数,称为水的离子积常数,简称水的离子积,用KW表示。即KW=c(H+)·c(OH―)。25℃时,c(H+)=(OH―)=10―7mol·L―1。25℃时,KW=1×10―14。100℃时,c(H+)=c(OH-)=1×10-6mol/L。100℃时c(H+)·c(OH-)=1×10-12=Kw【要点诠释】①KW与温度有关,随温度升高而逐渐增大。因水的电离是吸热过程,升高温度Kw将增大。②KW=1.0×10-14不仅适用于纯水(或其他中性溶液),也适用于酸、碱、盐的稀溶液。③在不同溶液中c(H+)、c(OH―)可能不同,但任何溶液中由水电离的c(H+)与c(OH―)总是相等的。KW=c(H+)·c(OH―)式中,c(H+)、c(OH―)均表示整个溶液中总物质的量浓度。④KW是有单位的,其单位为mol2·L―2,因其复杂通常省略。3.影响水的电离平衡的因素。H2O⇋H++OH—(1)定性分析,完成下表:(“—”表示不变)高二化学·选修4知识点总结2条件移动方向电离程度c(H+)c(OH-)KW温度不变加入HCl逆减小增大减小—NaOH逆减小减小增大—H2O—————CH3COONa正增大减小增大—NH4Cl正增大增大减小—NaCl—————Na正增大减小增大—升温加热正增大增大增大增大温度:由于水的电离吸热,温度越高,水的电离程度越大,KW越大,但仍为中性。据此,降温时KW减小,升温时KW增大。但不论温度升高或降低,纯液态水中c(H+)和c(OH―)都相等。实验测得25℃时KW约为10―14,100℃时KW约为10―12。外加酸、碱:向纯水中加入酸或碱,可以增大水中的H+或OH―浓度,均可使水电离平衡向逆反应方向移动(抑制水的电离)。加入能水解的盐:水的电离程度增大,若盐水解呈酸性,c(H+)>c(OH―);若盐水解呈碱性,c(H+)<c(OH―),但溶液中KW不变。加入活泼金属:由于活泼金属与水电离出的H+反应,促进水的电离,溶液中c(OH―)增大,c(H+)减小。定量分析,完成下表:计算酸碱盐溶液中c(H+)溶液、c(OH-)溶液、c(H+)水、高二化学·选修4知识点总结3c(OH-)水CH3COOH溶液NH3·H2O溶液CH3COONa溶液NH4Cl溶液pH212122c(H+)溶液10-210-1210-1210-...