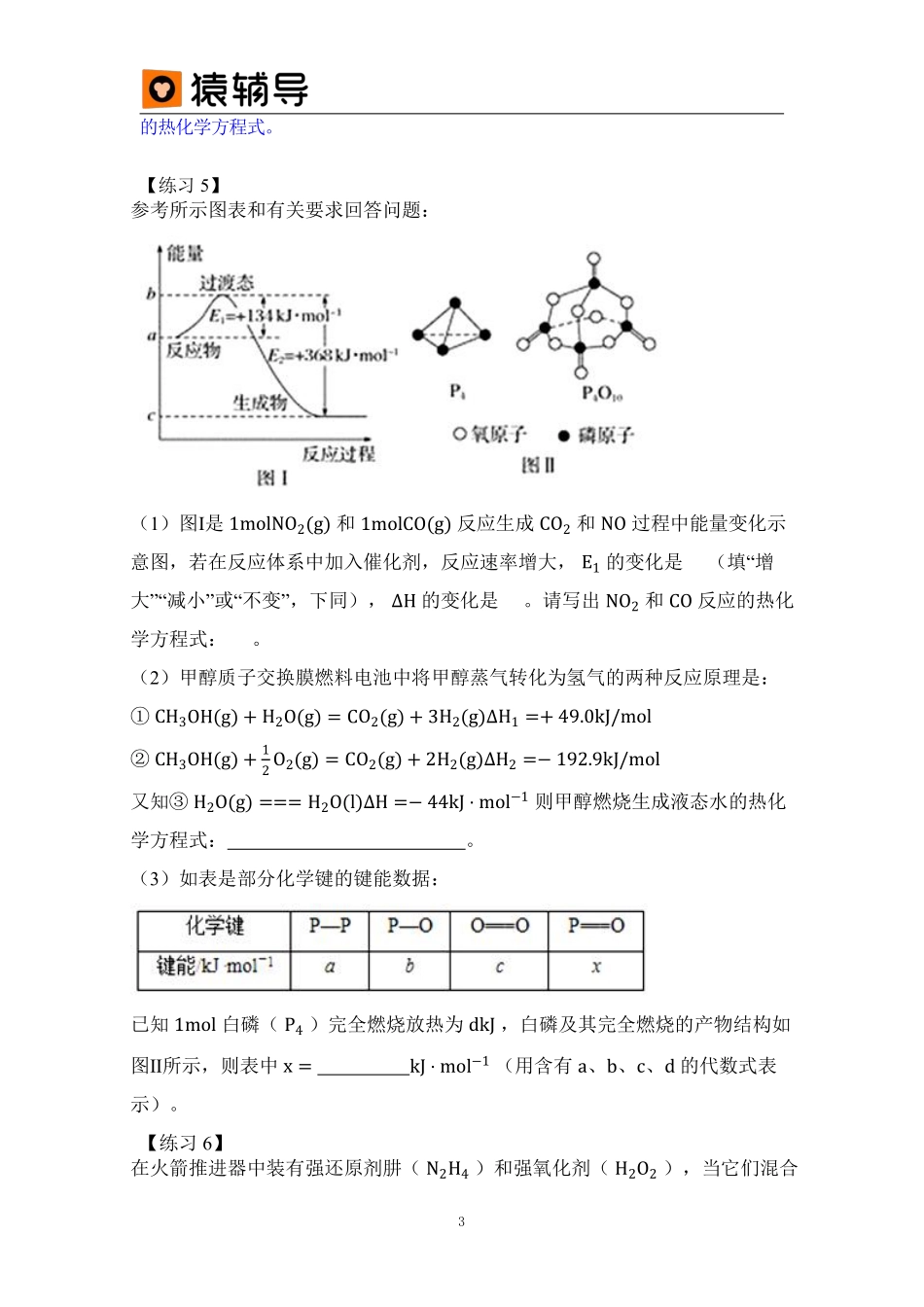
1第1讲热化学计算题型易错点:化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。【练习1】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是()A.1molN2(g)和NA个O2(g)反应放出的能量为180kJB.1molN2(g)和1molO2(g)具有总能量小于2molNO(g)具有的总能量C.通常情况下,N2(g)和O2(g)混合能直接生成NOD.吸热反应一定需要加热才能发生易错点:明确图象信息是解题关键;根据图象分析:A→B+C能量升高,是吸热反应;B+C→A能量降低,是放热反应,同一反应的正逆两个方向的反应反应热大小相等符号相反。【练习2】由下图分析可知下列说法正确的是()。A.A→B+C和B+C→A两个反应吸收或放出能量不等B.A→B+CΔH<0C.A具有的焓高于B和C具有的焓总和D.A→B+CΔH>0,则B+C→AΔH<02易错点:1、两条基本自然定律:1)质量守恒定律:自然界的物质可以发生相互转化,但是其总质量保持不变.2)能量守恒定律:一种能量可以转变为另一种能量,但是能量的总量是保持不变的.2、化学变化中能量变化的形式:1)能量变化的原因:化学键的断裂和形成是化学反应中能量变化的主要原因;2)能量变化的表现形式:物质发生化学变化的同时还伴随着能量的变化,而这种能量的变化又通常表现为热能变化;吸放热反应的判断:一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物总能量的相对大小。【练习3】下列叙述正确的是()。A.化学键存在所有单质和化合物中B.化学键的断裂和形成是化学反应能量变化的主要原因C.只要有能量变化,则一定发生了化学反应D.当反应物的总能量低于生成物的总能量时,该反应放出能量【练习4】在密闭容器中充入4molSO2和3molO2,一定条件下建立如下平衡:,测得SO2的转化率为90%,则在此条件下反应放出的热量为()。A.2QkJB.QkJC.1.8QkJD.0.9QkJ易错点:盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。该定律使用时应注意:1、盖斯定律只适用于等温等压或等温等容过程,各步反应的温度应相同;2、热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整3的热化学方程式。【练习5】参考所示图表和有关要求回答问题:(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是...