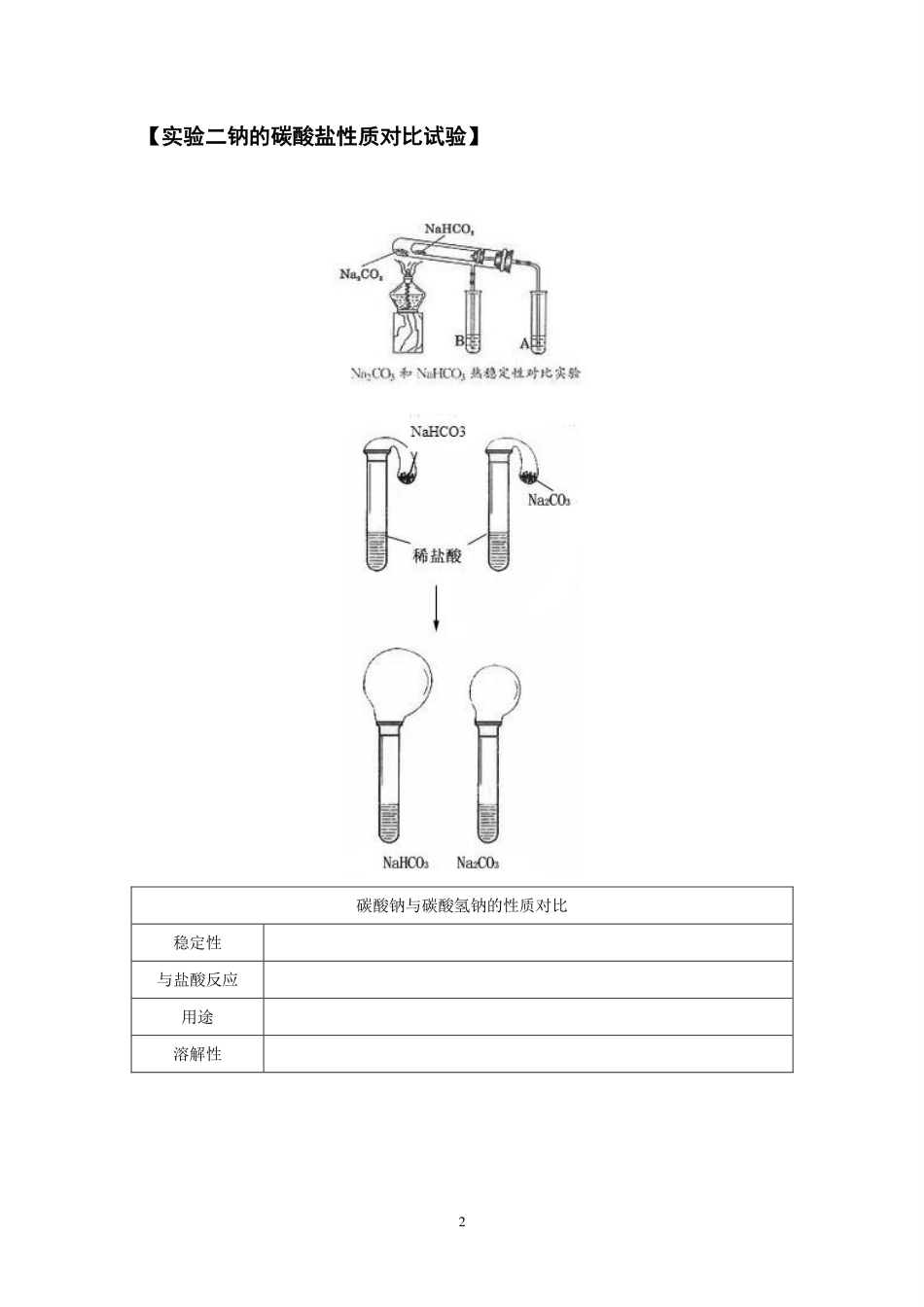
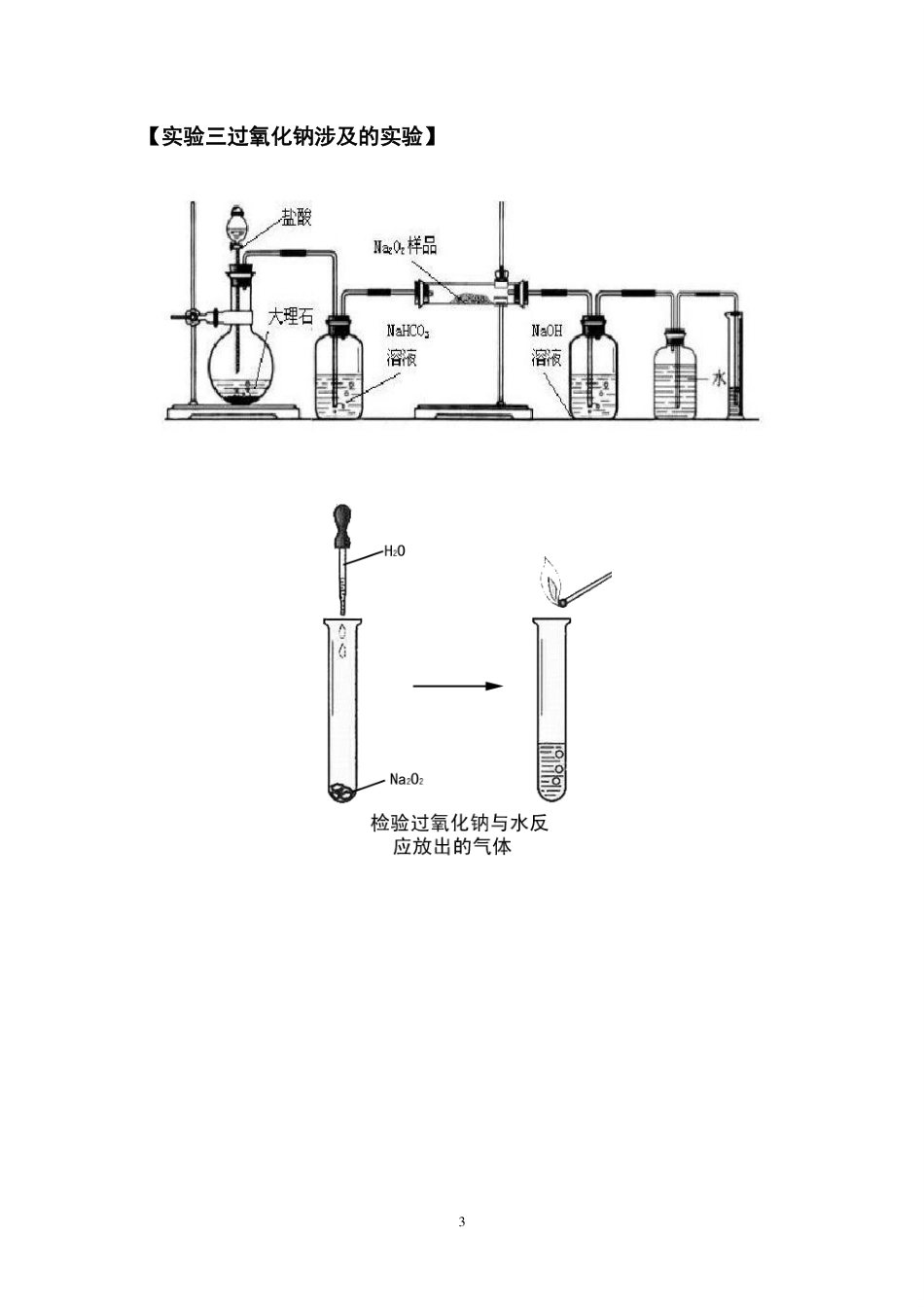
1实验专题第六讲碱金属的重要实验与侯德榜制碱【实验一碱金属与水的反应】金属钠与水反应现象分析浮在水面熔成光亮小球四处游动发出滋滋响声滴入酚酞溶液变红其它备注碱金属与煤油、水的反应现象金属钠金属钾2【实验二钠的碳酸盐性质对比试验】碳酸钠与碳酸氢钠的性质对比稳定性与盐酸反应用途溶解性3【实验三过氧化钠涉及的实验】4【实验四侯德榜制碱】其化学方程式可以归纳为以下三步反应。(1)NH3+H2O+CO2=NH4HCO3(首先通入氨气,然后再通入二氧化碳)(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(NaHCO3溶解度最小,所以析出,)(3)2NaHCO3=Na2CO3+CO2↑+H2O(NaHCO3热稳定性很差,受热容易分解)且利用NH4Cl的溶解度,可以在低温状态下向(2)中的溶液加入NaCl,则NH4Cl析出,得到化肥,提高了NaCl的利用率,NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在278K~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。