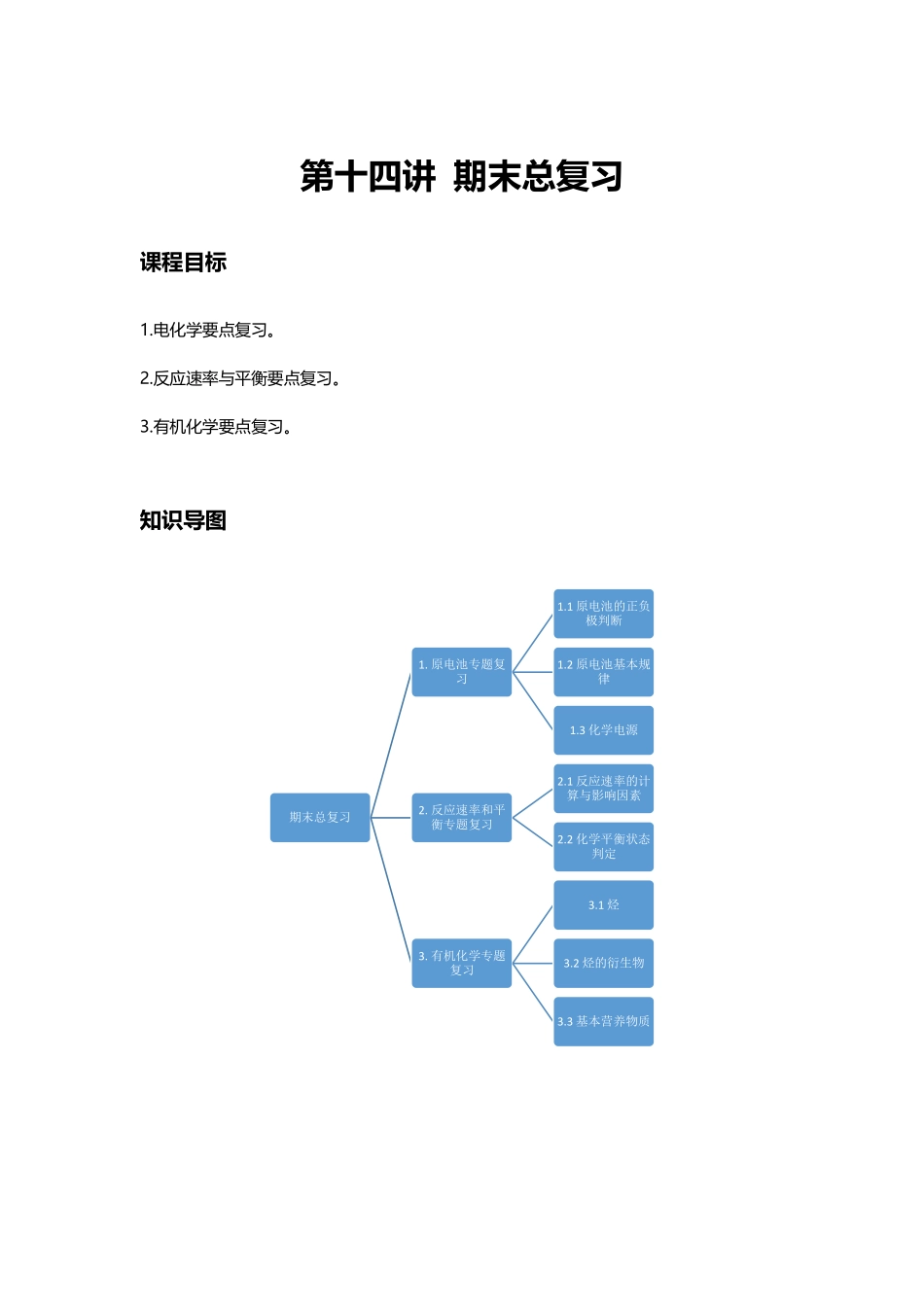
第十四讲期末总复习课程目标1.电化学要点复习。2.反应速率与平衡要点复习。3.有机化学要点复习。知识导图期末总复习1.原电池专题复习1.1原电池的正负极判断1.2原电池基本规律1.3化学电源2.反应速率和平衡专题复习2.1反应速率的计算与影响因素2.2化学平衡状态判定3.有机化学专题复习3.1烃3.2烃的衍生物3.3基本营养物质模块一原电池专题复习知识精讲一、原电池的正负极判断1.由组成原电池的两极材料判断一般来说,较活泼的或能和电解质溶液反应的金属为负极,较不活泼的金属或能导电的非金属为正极.但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;但镁、铝电极在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生反应,失去电子,因此铝为负极,镁为正极。2.根据外电路电流的方向或电子的流向判断在原电池的外电路,电流由正极流向负极,电子由负极流向正极。3.根据内电路离子的移动方向判断在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。4.根据原电池两极发生的化学反应判断:原电池中,负极总是发生氧化反应,正极总是发生还原反应.因此可以根据总化学方程式中化合价的升降来判断。二、原电池的基本规律外电路:电子移动方向,负极→正极;电流方向,正极→负极;内电路:离子迁移方向,阳离子向正极移动,阴离子向负极移动;电流方向:负极→正极。三、化学电源1.锌锰干电池(1)结构锌锰干电池是以锌筒为负极,石墨棒为正极,在石墨棒周围填充糊状的MnO2和NH4Cl作电解质。(2)电极反应负极:Zn-2e-=Zn2+正极:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O(3)缺陷与改进措施锌锰干电池电量小,而且在放电过程中容易发生胀气或漏液,会导致电器设备的腐蚀。改进措施:①在外壳套上防腐金属筒或塑料筒制成防漏电池;②将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰干电池。2.充电电池充电电池又称二次电池。其能量的转化关系是放电时,化学能转化为电能;充电时,电能转化为化学能。(1)铅蓄电池常作汽车电瓶,电压稳定,使用方便安全。负极材料是Pb,正极材料是PbO2,电解质溶液是硫酸溶液。总反应:Pb+PbO2+2H2SO42PbSO4+2H2O。(2)镍镉电池以Cd为负极,NiO(OH)为正极,以KOH为电解质,寿命比铅蓄电池长,但镉是致癌物质,废弃的镍镉电池如不回收,会严重污染环境。(3)锂离子电池锂离子电池主要依靠锂离子在正极和负极之间移动来工作。锂离子电池是新一代可充电的绿色电池...