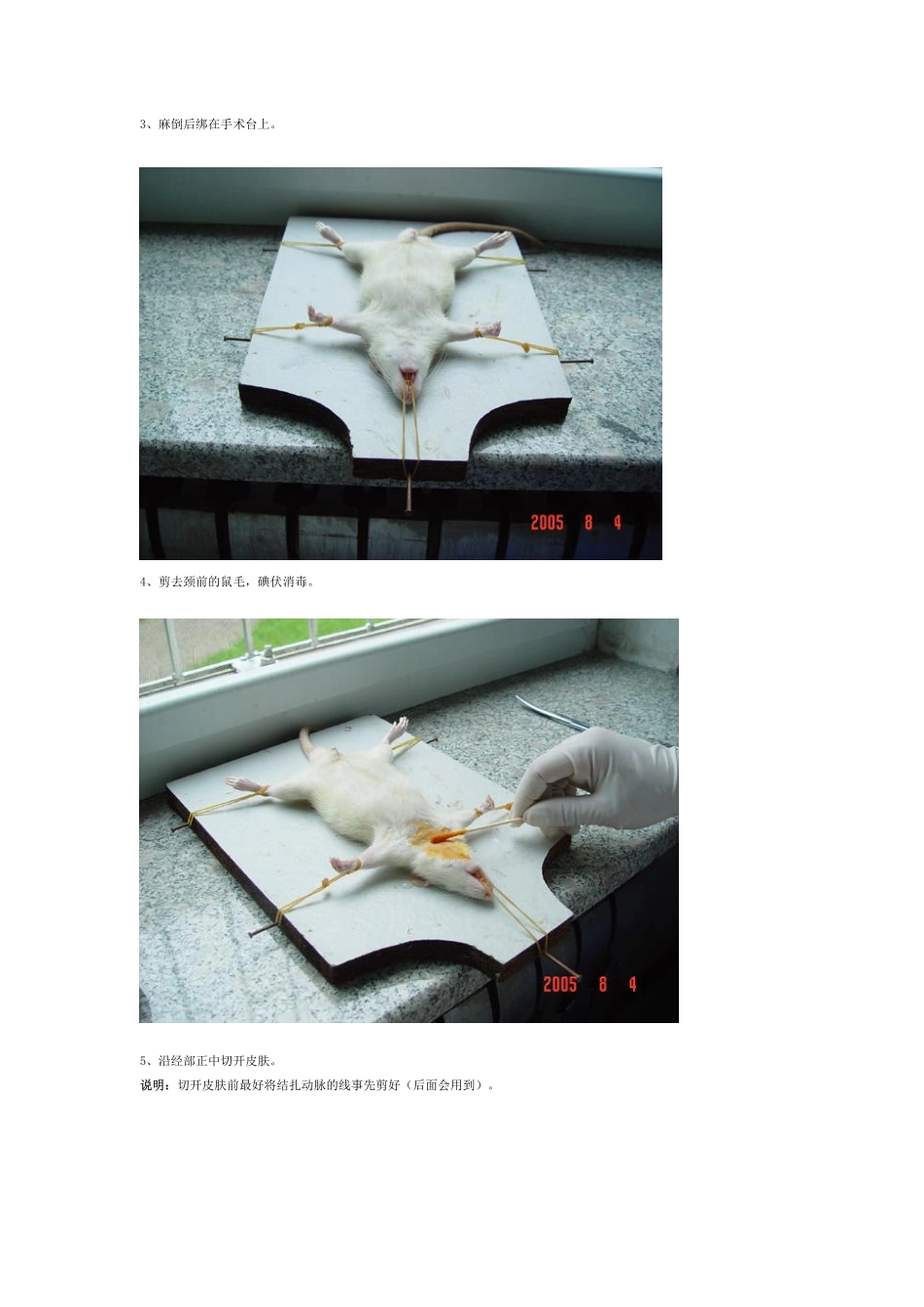
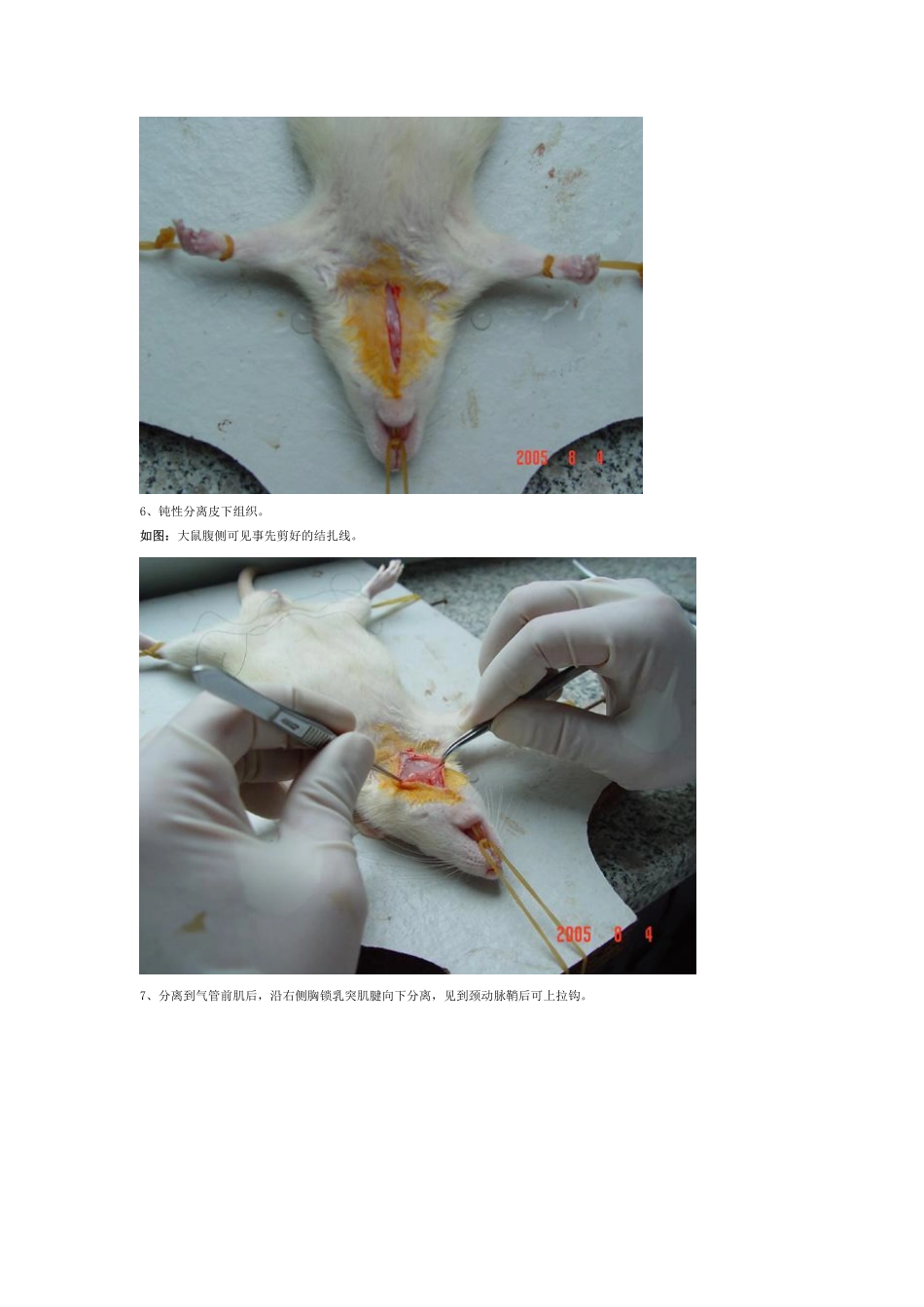
第一部分线栓模型制作1、实验器材(从左到右):第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材第三行:记号笔、自制拉钩(皮筋+曲别针+大头针)2、麻醉:可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。效果图3、麻倒后绑在手术台上。4、剪去颈前的鼠毛,碘伏消毒。5、沿经部正中切开皮肤。说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。6、钝性分离皮下组织。如图:大鼠腹侧可见事先剪好的结扎线。7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。8、分离动脉鞘。如图:分离好后见光滑的颈总动脉。9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。说明:(1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。我们的经验是:250g以下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。(2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。(3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。(4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。我们曾试过0.26mm的鱼线(不带腊)在250g以下的大鼠进入深度足有2.5cm12、成功后结扎中间那根线,可见第一个标记距动脉分叉约2mm。13、缝合。14、缝好后用酒精棉球消毒皮肤缝合处。15、缝好后的效果如图,外面的鱼线最后用记号笔涂黑,便于再灌拔线时观察。16、将大鼠放回笼内。17、2小时再灌。18、醒后看效果,左爪不能伸展(完全醒后可见绕圈或追尾、倾倒),我们的体会,症状2-3分的死亡率高,1-2分的死亡率低,有的大鼠第二天或几天后可无明显症状,但取脑后还是有梗死灶...