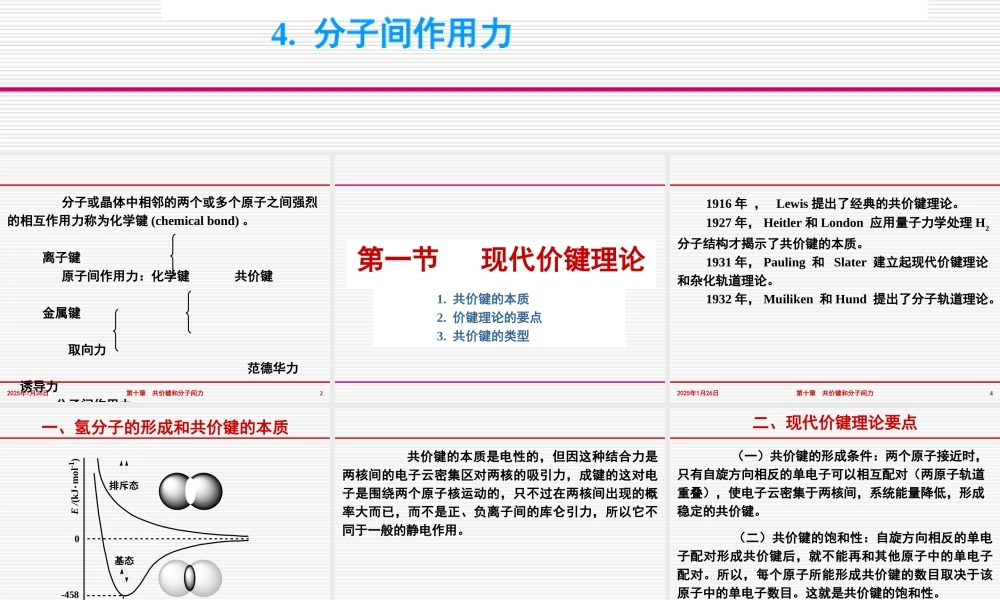
第十一章共价键和分子间作用力1.现代价键理论2.杂化轨道理论3.分子轨道理论4.分子间作用力2025年1月26日第十章共价键和分子间力2分子或晶体中相邻的两个或多个原子之间强烈的相互作用力称为化学键(chemicalbond)。离子键原子间作用力:化学键共价键金属键取向力范德华力诱导力分子间作用力第一节现代价键理论1.共价键的本质2.价键理论的要点3.共价键的类型2025年1月26日第十章共价键和分子间力41916年,Lewis提出了经典的共价键理论。1927年,Heitler和London应用量子力学处理H2分子结构才揭示了共价键的本质。1931年,Pauling和Slater建立起现代价键理论和杂化轨道理论。1932年,Muiliken和Hund提出了分子轨道理论。2025年1月26日第十章共价键和分子间力5一、氢分子的形成和共价键的本质-45874核间距/pm基态排斥态0E/(kJmol-1)2025年1月26日第十章共价键和分子间力6共价键的本质是电性的,但因这种结合力是两核间的电子云密集区对两核的吸引力,成键的这对电子是围绕两个原子核运动的,只不过在两核间出现的概率大而已,而不是正、负离子间的库仑引力,所以它不同于一般的静电作用。2025年1月26日第十章共价键和分子间力7(一)共价键的形成条件:两个原子接近时,只有自旋方向相反的单电子可以相互配对(两原子轨道重叠),使电子云密集于两核间,系统能量降低,形成稳定的共价键。(二)共价键的饱和性:自旋方向相反的单电子配对形成共价键后,就不能再和其他原子中的单电子配对。所以,每个原子所能形成共价键的数目取决于该原子中的单电子数目。这就是共价键的饱和性。二、现代价键理论要点2025年1月26日第十章共价键和分子间力8(三)共价键的方向性:成键时,两原子轨道重叠愈多,两核间电子云愈密集,形成的共价键愈牢固,这称为原子轨道最大重叠原理。据此,共价键的形成将尽可能沿着原子轨道最大程度重叠的方向进行。原子轨道中,除s轨道呈球形对称外,p、d等轨道都有一定的空间取向,它们在成键时只有沿一定的方向靠近达到最大程度的重叠,才能形成稳定的共价键,这就是共价键的方向性。2025年1月26日第十章共价键和分子间力9+-zx1s3px(a)+2025年1月26日第十章共价键和分子间力10+-zx1s3px(b)+2025年1月26日第十章共价键和分子间力11+-zx1s3px(c)+2025年1月26日第十章共价键和分子间力12+-zx1s3px(d)+2025年1月26日第十章共价键和分子间力13+-zx1s3px(e)+2025年1月26日第十章共价键和分子间力14(三)共价键的类型按原子轨道重叠方式不...