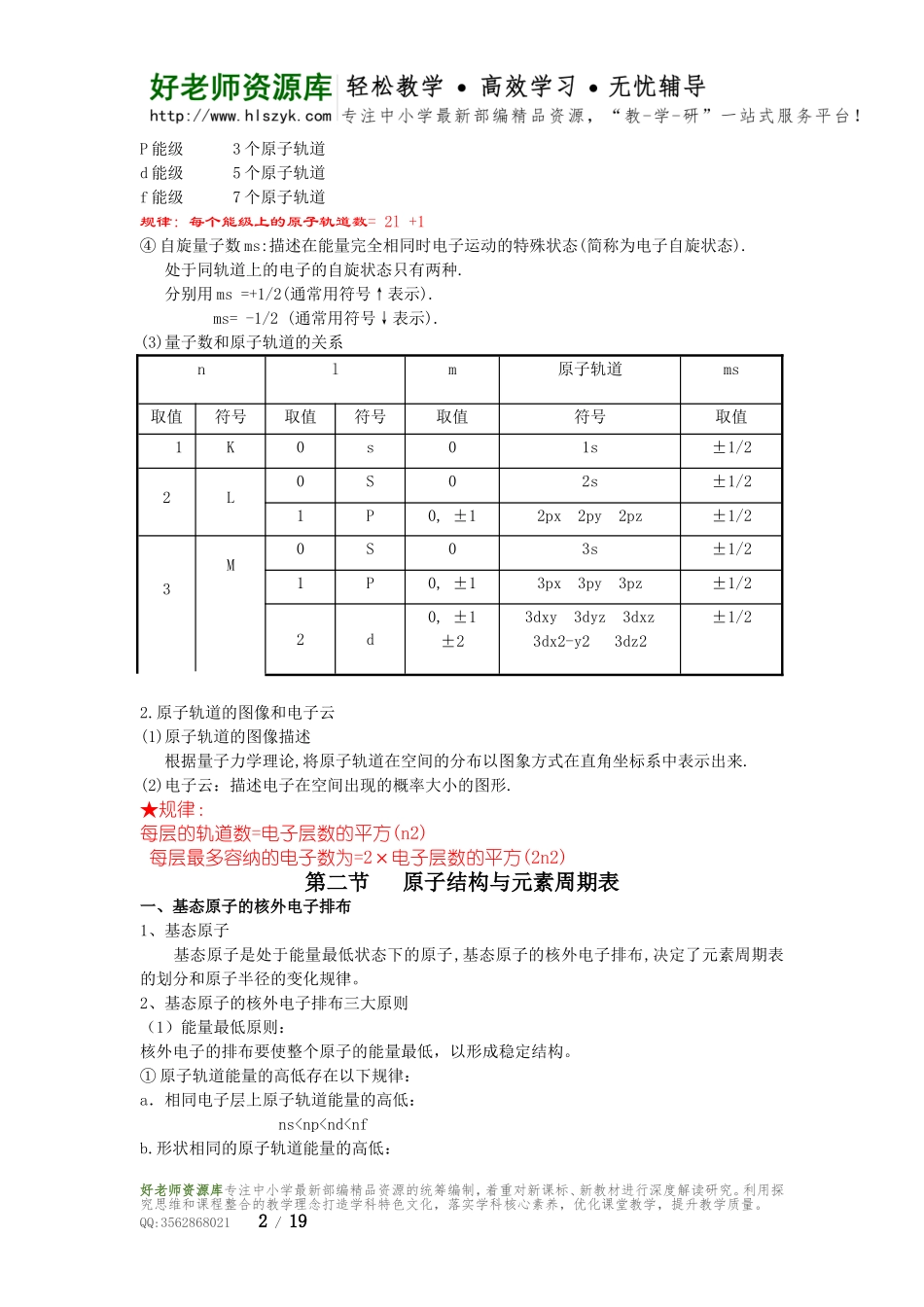
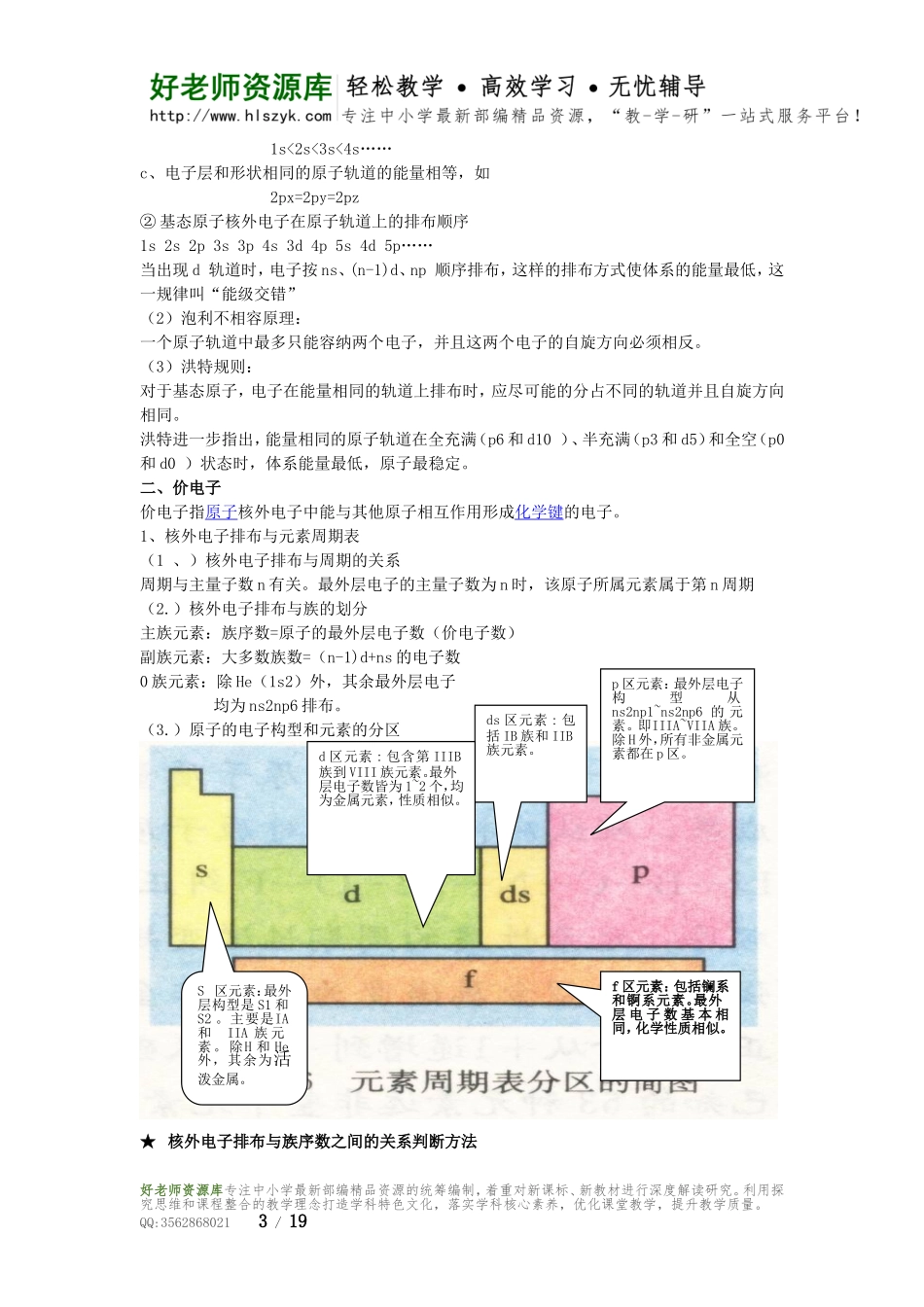
化学第一单元第一节一、原子的发现史1.道尔顿原子模型(1803年)2.汤姆生原子模型(1903年)3.卢瑟福原子模型(1911年)原子中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就象行星环绕太阳运转一样。4.玻尔原子模型(1913年)(1)、氢原子光谱和玻尔的原子结构理论a.连续光谱——无数波长连续的光形成b.线状光谱——一些具有特定波长的光形成★玻尔理论的三个基本观点:(1)原子中的电子在具有确定半径的圆周轨道上绕原子核运动,并且不辐射能量;2)不同轨道上运动的电子具有不同能量,而且能量是量子化的,轨道能量依n值(1、2、3、·····)的增大而升高,n称为量子数。对氢原子而言,电子处在n=1的轨道是能量最低,称为基态,能量高于基态的状态,称为激发态;(3)只有当电子从一个轨道(能量为Ei)跃迁到另一个轨道(能量为Ej)时,才会辐射或吸收能量。如果辐射或吸收的能量以光的形式表现并被记录下来,就形成了光谱。5.量子力学模型(1927~1935年)二、量子力学对原子核外电子运动状态的描述1、原子轨道与四个量子数(1)量子力学中单个电子的空间运动状态称为原子轨道.每个原子轨道须由三个量子数n、l、m共同描述.(2)四个量子数①主量子数n:描述电子离核的远近.n取值为正整数1,2,3,4,5,6…对应符号为K,L,M,N,O,P…n所表示的运动状态称为电子层规律:每层的能级数值=电子层数②角量子数l:描述(电子云)原子轨道的形状.对于确定的n值,l共n个数值.l取值为0,1,2,3…(n-1).符号为s,p,d,f等.若电子n、l的相同,则电子的能量相同.在一个电子层中,l的取值有多少个,表示电子层有多少个不同的能级.规律:每层的能级数值=电子层数③磁量子数m:描述磁场中原子轨道的能量状态m可以取0、±1、±2…±l共(2l+1)个数值.如l=0,m只可以取0,对应的谱线只有一条.如l=1,m可以取0,±1,对应的谱线有三条.n、l、m确定,原子轨道就确定了.S能级1个原子轨道好老师资源库专注中小学最新部编精品资源的统筹编制,着重对新课标、新教材进行深度解读研究。利用探究思维和课程整合的教学理念打造学科特色文化,落实学科核心素养,优化课堂教学,提升教学质量。QQ:35628680211/19P能级3个原子轨道d能级5个原子轨道f能级7个原子轨道规律:每个能级上的原子轨道数=2l+1④自旋量子数ms:描述在能量完全相同时电子运动的特殊状态(简称为电子自旋状态).处于同轨道上的电子的自旋状态...